
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
| V |
| 22.4L/mol |
| V |
| 22.4 |
| V |
| 22.4 |
| V |
| 22.4 |
| 197V |
| 22.4 |
| 197V |
| 22.4 |
a-
| ||
| a |
a-
| ||
| a |


科目:高中化学 来源: 题型:
| A | B |
| C |
| A、B形成的单质存在同素异形体,C的单质不存在同素异形体 |
| B、C的最高价氧化物对应的水化物能与A的常见氢化物形成三种盐 |
| C、常温下,B的氢化物中无H+ |
| D、Y的种类比X多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
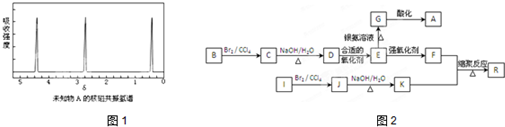
查看答案和解析>>
科目:高中化学 来源: 题型:
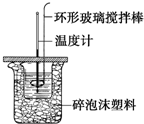 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| (m酸+m碱)?c?(t终-t始) |
| n |
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 盐酸溶液 | 氢氧化钠溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 | ⅠA | 0族 | ||||||
| 一 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 二 | ② | ③ | ||||||
| 三 | ④ | ⑤ | ⑥ | |||||
查看答案和解析>>
科目:高中化学 来源: 题型:
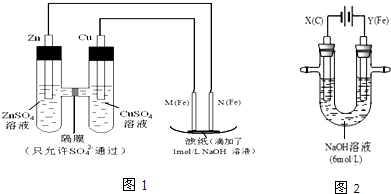
查看答案和解析>>
科目:高中化学 来源: 题型:
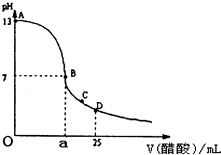 如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:
如图为向25mL0.1mol?L-NaOH溶液中逐滴加入0.2mol?L-醋酸溶液过程中溶液pH的变化曲线,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0? | B、-2 | C、+1 | D、+2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com