
【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)甲同学用pH试纸分别测定了 0.1 mol/L NaOH溶液的pH=13、0.1 mol/LCH3COOH溶液的pH=3、0.001 mol/L HCl溶液的pH=3。请写出pH试纸使用方法:_____根据测量结果,甲推测等浓度的NaOH溶液、CH3COOH溶液中,由水电离出的H+浓度c(H+)NaOH____c(H+)CH3COOH(填“大于”“小于”或“等于”)
(2)乙同学分别取了pH=3的CH3COOH溶液和HCl溶液各10mL,测量导电能力发现HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)。然后分别加水稀释到100 mL后,再次测量,稀释后的HCl溶液导电能力______________CH3COOH溶液导电能力(填“大于”“小于”或“等于”)
(3)丙同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2O![]() H2CO3
H2CO3![]() HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
HCO3-,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随c(HCO3-)∶c(H2CO3)变化关系如下表:
c(HCO3-) ∶c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
①正常人体血液中,HCO3-的水解程度____电离程度(填“>”、“<”或“=”);
②人体血液酸中毒时,可注射________(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
③等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序___________
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=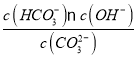 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,溶液的pH=________;
(4)丁同学探究难溶电解质在水溶液中的性质,查阅资料发现25 ℃时,AgCl的Ksp=1.8×10-10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl-)=______mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中再加入少量AgCl固体,则c(Cl-)_____(填“增大”或“减小”或“不变”)。
【答案】把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取少量待测液点在试纸的中部,变色后与标准比色卡对照读数 小于 等于 小于 > B c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) pH=10 1.8×10-8 不变
【解析】
(1)用pH试纸测定溶液的pH不能湿润;根据溶液中离子浓度对水电离平衡移动的影响分析比较溶液中水电离产生的离子浓度大小;
(2)溶液的导电性与溶液中微粒的浓度及离子带有的电荷数目有关,与微粒的种类无关;
醋酸是弱酸,在溶液中存在电离平衡,根据稀释对溶液中离子浓度的影响分析判断溶液的导电性;
(3)①根据人体血液的酸碱性确定碳酸氢根离子的电离和水解程度相对大小;
②发生酸中毒时,应该用碱性物质缓解;
③等浓度的Na2CO3和NaHCO3的混合,溶液由于水解而显碱性,根据物料守恒和两种盐的水解程度大小分析比较溶液中各离子浓度大小;
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=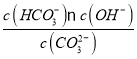 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,将数值带入,同时结合水的离子积常数及pH=-lgc(H+)溶液的pH;
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,将数值带入,同时结合水的离子积常数及pH=-lgc(H+)溶液的pH;
(4)先根据AgNO3、NaCl溶液中溶质的物质的量,结合二者反应关系判断哪种物质过量,计算出过量离子的物质的量浓度,利用Ksp(AgCl)计算出c(Cl-),在溶液中存在沉淀溶解平衡,根据固体与溶解平衡关系分析判断离子浓度情况。
(1)pH试纸的使用方法是:把一小块pH试纸放在表面皿(或玻璃片)上,用玻璃棒蘸取少量待测液点在试纸的中部,待变色后与标准比色卡对照读数;
0.1 mol/L NaOH溶液的pH=13,则c(OH-)=0.1mol/L;0.1 mol/LCH3COOH溶液的pH=3,则c(H+)=10-3mol/L,说明NaOH是一元强碱,醋酸是一元弱酸,等浓度的NaOH、CH3COOH溶液中离子浓度NaOH的大于醋酸的,由于在两种物质的溶液中都存在H2O的电离平衡:H2O![]() H++OH-,等浓度的H+、OH-对水的电离平衡抑制作用相同,由于等浓度的NaOH溶液中的离子浓度大于醋酸溶液中的离子浓度,所以对水的抑制作用NaOH>CH3COOH,故由水电离出的H+浓度c(H+)NaOH<c(H+)CH3COOH;
H++OH-,等浓度的H+、OH-对水的电离平衡抑制作用相同,由于等浓度的NaOH溶液中的离子浓度大于醋酸溶液中的离子浓度,所以对水的抑制作用NaOH>CH3COOH,故由水电离出的H+浓度c(H+)NaOH<c(H+)CH3COOH;
(2)溶液的导电性与溶液中微粒的浓度及离子带有的电荷数目有关,与微粒的种类无关。pH=3的CH3COOH溶液和HCl溶液各10mL,离子的浓度相等,离子所带电荷相同,所以溶液的导电能力也相等;
醋酸是一元弱酸,在溶液中存在电离平衡,c(CH3COOH)>c(H+),将两者10mL分别加水稀释到100 mL后,由于HCl是一元强酸,完全电离,稀释使溶液中离子浓度降低,而在CH3COOH溶液在存在电离平衡,稀释电离平衡正向移动,又使溶液中的离子浓度增大,最终达到平衡时,溶液中离子浓度CH3COOH溶液>HCl溶液,故稀释相同倍数后溶液的导电性:HCl<CH3COOH;
(3)①人体血液pH值保持在7.35~7.45之间,说明HCO3-的水解程度大于电离程度;
②发生酸中毒时,应用碱性物质缓解;
A.NaOH溶液是强碱溶液,具有强腐蚀性,不能使用,A不符合题意;
B.NaHCO3溶液水解显碱性,可以和酸反应起到缓解人体血液酸中毒,B符合题意;
C.NaCl溶液是中性溶液不起作用,C不符合题意;
D.Na2SO4溶液是中性溶液不能缓解血液的酸性,D不符合题意;
故合理选项是B;
③等浓度的Na2CO3和NaHCO3的混合,根据电解质的电离可知c(Na+)最大,由于Na2CO3和NaHCO3水解使溶液显碱性,所以c(OH-)>c(H+),水解程度CO32->HCO3-,则c(HCO3-)>c(CO32-),盐电离产生的离子浓度远大于水电离产生的H+、OH-的浓度,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故该混合溶液中各离子浓度大小顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
④已知25 ℃时,CO32-水解反应的平衡常数Kh=![]() =
=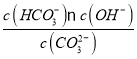 =2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,Kh=
=2×10-4 mol/L,当溶液中c(HCO3-)︰c( CO32-)=2:1时,Kh==2×c(OH-)=2×10-4 mol/L,所以c(OH-)=1×10-4 mol/L,c(H+)=10-10mol/L所以溶液的pH=10;
(4)1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01mol/L的NaCl溶液后,二者发生反应:Ag++Cl-=AgCl↓,根据反应关系可知:硝酸银过量,氯化钠完全反应,剩余的硝酸银浓度c(AgNO3)=c(Ag+)=![]() =0.01mol/L,根据AgCl的Ksp=1.8×10-10,可知c(Cl-)=
=0.01mol/L,根据AgCl的Ksp=1.8×10-10,可知c(Cl-)=![]() =1.8×10-8;反应后AgCl溶液形成沉淀溶解平衡体系,加入氯化银固体不影响平衡,因此溶液中氯离子浓度不变。
=1.8×10-8;反应后AgCl溶液形成沉淀溶解平衡体系,加入氯化银固体不影响平衡,因此溶液中氯离子浓度不变。


科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是( )

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能用于做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2和N2O4的混合气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)![]() pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
pC(g)+qD(g),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②体系密度不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥单位时间内m mol A发生断键反应,同时p mol C也发生断键反应
A.③④⑤⑥B.①③④⑥C.②③④⑥D.①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入到一定浓度的稀硝酸中,金属恰好完全溶解,反应后溶液中存在:![]() ,则参加反应的Fe和HNO3的物质的量之比为( )
,则参加反应的Fe和HNO3的物质的量之比为( )
A.5∶16B.1∶1C.2∶3D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)“民以食为天,食以安为先”。近年来屡屡发生的 劣质奶粉、苏丹红、多宝鱼等食品安全事件严重威胁消费者的健康和生命安全。下列有关蛋白质的说法正确的是____________(填序号)。
A.蛋内质是重要的营养物质,也是提供人体所需能最的主要物质
B.蛋白质在淀粉酶的作用下,可水解成葡萄糖等
C.蛋白质水解的最终产物是氨基酸
(2)奶粉中蛋内质含量的国家标准是:每100 g婴幼儿奶粉中含蛋白质1225 g。其测定方法是:奶粉经水解产生氨基酸,再经过其他反应生成氨, 由氨的量计算出氮的量,再由氮的量求出蛋白质的含量(蛋白质含氮量按16%计算)。某市质检局取100 g市场中的某个品牌的奶粉样品进行检验。该样品进行反应后生成的![]() 和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
和 7.5 g 19. 6%的稀硫酸恰好完全反应,通过计算可判断出这种奶粉__________(填“属于”或“不属于”)合格奶粉。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,碳钢腐蚀与溶液pH的关系如下:
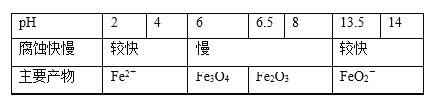
下列说法不正确的是( )
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加![]() ,试回答:
,试回答:
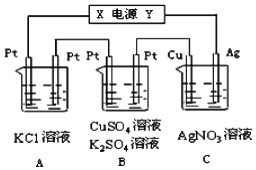
(1)电源电极X名称为______。
(2)电解池中溶液pH变化![]() 选填“增大”、“减小”、“不变”
选填“增大”、“减小”、“不变”![]() :C池______。
:C池______。
(3)B中阳极的电极反应式为______。
(4)A中发生反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 硅晶体中,有NA个Si就有2 NA个Si—Si键
B. 常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
C. 惰性电极电解食盐水,若线路中通过2 NA个电子的电量时,则阳极产生气体22.4 L
D. 标准状况下,2 mol Na2O2与44.8 L SO2完全反应,转移的电子数目为2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com