
| A、分子数之比等于1:1 |
| B、原子数之比等于3:2 |
| C、质量之比等于7:11 |
| D、质子数之比等于7:11 |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子晶体中都存在共价键 |
| B、金属晶体的熔点都比分子晶体的熔点高 |
| C、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
D、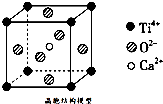 某物质晶胞结构如图,该物质的化学式为CaTiO3(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5:2 | B、1:1 |
| C、3:1 | D、1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,1mol水的体积是22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4L |
| D、在标准状况下,总质量为28g的N2和CO的混合气体,其体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用丁达尔效应区分胶体与溶液 |
| B、生石灰与水混合过程只发生物理变化 |
| C、臭氧是由三个氧原子构成的化合物 |
| D、CuSO4?H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有多种元素符合本题条件 |
| B、符合本题的HxROy有一元酸和多元酸 |
| C、z与x的数值相等 |
| D、R可能是第二周期元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com