
| A、分子晶体中都存在共价键 |
| B、金属晶体的熔点都比分子晶体的熔点高 |
| C、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
D、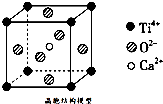 某物质晶胞结构如图,该物质的化学式为CaTiO3(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、碳酸氢钠的水解反应:HCO3-+H2O?CO32-+H+ |
| B、铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ |
| C、亚硫酸溶液中通入氧气:2H2SO3+O2═4H++2SO42- |
| D、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示.利用标签提供的信息,回答下列问题:
乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示.利用标签提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2作为氧化剂得到的电子数为NA |
| B、在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 |
| C、14 g氮气中含有7 NA个电子 |
| D、NA个一氧化碳分子和0.5 molCH4所含原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ/mol,E反应物>E生成物 | ||||
| B、CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ/mol,E反应物>E生成物 | ||||
C、HI(g)?
| ||||
| D、H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是银白色,质软的金属 |
| B、铊位于第六周期第ⅢA族 |
| C、铊和稀硝酸反应生成Tl(NO3)3 |
| D、Tl(OH)3和Al(OH)3一样是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ |
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、硫酸铜与烧碱溶液反应:CuSO4+2OH-═Cu(OH)2↓+SO42- |
| D、氢氧化铝中和胃酸:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子数之比等于1:1 |
| B、原子数之比等于3:2 |
| C、质量之比等于7:11 |
| D、质子数之比等于7:11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
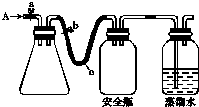 实验室用下列方法测定某水样中O2的含量.
实验室用下列方法测定某水样中O2的含量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com