
【题目】按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
C2H5OH+HBr→C2H5Br+H2O
主要实验步骤如下:①连接好装置,检查装置的气密性;②向烧瓶中加入一定量的苯和液溴.向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处;③将A装置中的纯铁丝小心向下插入混合液中;④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min.
请填写下列空白:
(1)写出制取溴苯的化学方程式: .
(2)步骤③中观察到的现象是: .
(3)C装置中U形管内部用蒸馏水封住管底的作用是: .
(4)反应完毕后,U形管内的现象是: . 分离溴乙烷时所用的最主要仪器的名称是(只填一种) .
(5)实验结束,从烧瓶的混合物中分离出粗制黄色的溴苯,产生黄色的原因是其中含有(填化学式).欲得到无色的溴苯的方法是(填试剂和操作名称).
【答案】
(1)C6H6+Br2 ![]() C6H5Br+HBr
C6H5Br+HBr
(2)剧烈反应,瓶上方有红棕色气体产生
(3)一是溶解溴化氢、二是液封(防止产物及溴化氢挥发)
(4)U形管中蒸馏水底部有无色油状液体;分液漏斗
(5)Br2;用NaOH溶液洗涤分液
【解析】解:(1)将A装置中的纯铁丝小心向下插入混合液中,铁和溴反应生成三溴化铁,2Fe+3Br2=2FeBr3 , 三溴化铁与苯作用,生成溴苯和铁,同时有溴化氢生成,铁作催化剂,所以制备溴苯的化学反应方程式为:C6H6+Br2 ![]() C6H5Br+HBr, 所以答案是:C6H6+Br2
C6H5Br+HBr, 所以答案是:C6H6+Br2 ![]() C6H5Br+HBr;(2)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫,该反应为放热反应且反应剧烈,苯和溴单质沸点低,易挥发,溴蒸气为红棕色,所以步骤③中观察到的现象是:剧烈反应,瓶上方有红棕色气体产生,
C6H5Br+HBr;(2)苯和液溴在铁粉催化作用下发生取代反应生成溴苯和溴化氫,该反应为放热反应且反应剧烈,苯和溴单质沸点低,易挥发,溴蒸气为红棕色,所以步骤③中观察到的现象是:剧烈反应,瓶上方有红棕色气体产生,
所以答案是:剧烈反应,瓶上方有红棕色气体产生;(3)CH3CH2Br难溶于水,溴化氢极易溶于水,形成的氢溴酸是强酸,U形管内的蒸馏水用来溶解吸收HBr,防止HBr及CH3CH2Br逸出,
所以答案是:一是溶解溴化氢、二是液封(防止产物及溴化氢挥发);(4)溴乙烷是一种无色的油状液体物质,和水是互不相溶的,反应完毕,U形管内会发生液体分层现象,上层为水层,下层为无色油状液体(溴乙烷),可以采用分液的方法来实现物质的分离,最主要仪器为分液漏斗,
所以答案是:U形管中蒸馏水底部有无色油状液体;分液漏斗;(5)过量的溴溶解在溴苯中而使溴苯显黄色,常温下,氢氧化钠可以和溴单质反应,和溴苯不互溶,不反应,欲得到无色的溴苯可用NaOH溶液洗涤:2NaOH+Br2═NaBr+NaBrO+H2O,再用分液的方法分离,
所以答案是:Br2;用NaOH溶液洗涤分液.


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算浓度时假定溶液体积没有变化):
①向其中一份固体中加入100mL 2.0mol/L的NaOH溶液,加热使其充分反应后过滤,测得滤液的c(OH-)=1mol/L;
②向另一份固体中加入140mL 4.0 mol/L的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且c(H+)=1mol/L。
(1)写出该铝热反应的化学方程式:_______________________________
写出实验①发生的离子方程式:_________________________________。
(2)这包铝热剂中铝粉的质量为___________________________。
(3)这包铝热剂中氧化铁粉末的质量为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料。自然界中存在如下图所示的氮元素的循环过程,下列说法不正确的是
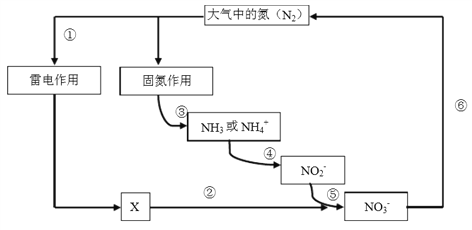
A. 过程①“雷电作用”中发生的反应是:N2 + O2 === 2NO
B. 过程③ “固氮作用”中,氮气被还原
C. ⑤中涉及的反应可能有: 2 NO2 + O2 === 2 NO3
D. ⑥中涉及的反应可能有: 2NO3- + 12H+ === N2+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合如图(部分产物已略去).下列说法中,正确的是( ) 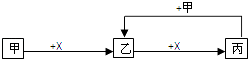
A.若甲为单质铁,则丙一定为FeCl3
B.若甲为强碱,则X一定为CO2
C.若乙是一种白色胶状沉淀,则甲溶液中一定含有Al3+
D.若甲为单质,则此关系中涉及的反应一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将3molA和3molB充入体积为 1L的密闭容器中,发生如下反应:aA(g)+2B(g)3C(g)+D(g).反应达到平衡后,C的浓度为 3mol/L.压缩容器体积,使容器的体积减小一半,建立新的平衡时,B的浓度为2mol/L.则方程式中a的数值为( )
A.1
B.2
C.3
D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率.
①该反应的离子方程式为 .
②设计实验方案:通过测量计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1molL﹣1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①﹣⑥所代表的必要数据或物理量
物理量 | V(0.1molL﹣1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
实验1 | a | b | 0 | c | d | |
实验2 | 0 | c | d | |||
实验3 | c | 0 | d |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com