
【题目】碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率.
①该反应的离子方程式为 .
②设计实验方案:通过测量计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1molL﹣1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①﹣⑥所代表的必要数据或物理量
物理量 | V(0.1molL﹣1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
实验1 | a | b | 0 | c | d | |
实验2 | 0 | c | d | |||
实验3 | c | 0 | d |
【答案】
(1)CaCO3+2HCl=CaCl2+H2O+CO2↑;生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间
(2)生成等质量二氧化碳所需时间;a;b;b;d
【解析】解:(1)①碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;②可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率,
故答案为:生成二氧化碳的体积和反应时间;消耗碳酸钙固体的质量和反应时间;(2)①在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率,
故答案为:生成等质量二氧化碳所需时间;②据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验,
物理量 | V(0.1mol/L的HCl)/mL | m(块状碳酸钙质量)/g | m(粉末状碳酸钙质量)/g | V(蒸馏水)/mL | m(二氧化碳)/g | 反应时间 |
实验1 | a | b | c | d | ||
实验2 | a | b | c | d | ||
实验3 | c | b | a | d |
表中①﹣⑥所代表的必要数据或物理量分别为:①a ②b ③b ④a ⑤m(CO2)/g ⑥时间/s,
故答案为:①a; ②b;③b; ④a; ⑤m(CO2)/g;⑥时间/s.
(1)①碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,据此书写化学方程式;②测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率,可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率;(2)(i)在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率;(ⅱ)据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将5mol·L-1盐酸10mL稀释到200mL,再取出5mL,这5mL溶液的物质的量浓度是( )
A. 0.05mol·L-1B. 0.25mol·L-1C. 0.1mol·L-1D. 0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
C2H5OH+HBr→C2H5Br+H2O
主要实验步骤如下:①连接好装置,检查装置的气密性;②向烧瓶中加入一定量的苯和液溴.向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处;③将A装置中的纯铁丝小心向下插入混合液中;④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min.
请填写下列空白:
(1)写出制取溴苯的化学方程式: .
(2)步骤③中观察到的现象是: .
(3)C装置中U形管内部用蒸馏水封住管底的作用是: .
(4)反应完毕后,U形管内的现象是: . 分离溴乙烷时所用的最主要仪器的名称是(只填一种) .
(5)实验结束,从烧瓶的混合物中分离出粗制黄色的溴苯,产生黄色的原因是其中含有(填化学式).欲得到无色的溴苯的方法是(填试剂和操作名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择萃取剂将碘水中的碘萃取出来,这种萃取剂应具备的性质是( )
A. 不溶于水,且必须易与碘发生化学反应 B. 不溶于水,且比水更容易使碘溶解
C. 不溶于水,且必须比水密度大 D. 不溶于水,且必须比水密度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法正确的是
A. 分离汽油和水可以用结晶的方法
B. 除去氯化钠溶液中的泥沙用分液的方法
C. 分离醋酸(沸点118℃)与乙酸乙酯(沸点77.1℃)用蒸馏的方法
D. 从含有少量氯化钠的硝酸钾溶液中提取硝酸钾用过滤的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体和溶液的叙述正确的是
A. 胶体为分散质粒子直径在10nm~100nm之间的分散系
B. 可利用过滤的方法分离胶体和溶液
C. 溶液是混合物,胶体是纯净物
D. 利用丁达尔效应可以区别胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进行过滤操作应选用的一组仪器是( )
A. 滤纸、烧杯、试管夹、漏斗、玻璃棒
B. 烧杯、酒精灯、试管、漏斗
C. 漏斗、玻璃棒、烧杯、铁架台、滤纸
D. 玻璃棒、滤纸、烧瓶、漏斗、铁架台
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某儿童微量元素体检报告单的部分数据:
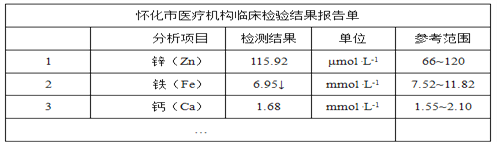
根据上表的数据,回答下列问题:
(1)该儿童__元素含量偏低。
(2)报告单中“μmol·L-1”是__(填“质量” “体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+。在这个过程中维生素C表现出__________(填“氧化性”或“还原性”)。
(4)硫酸亚铁晶体(FeSO47H2O)在医疗上可作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如图:
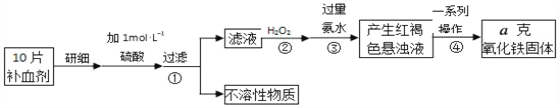
请回答下列问题:
a.②中H2O2的作用是__。
b.④中一系列处理的操作步骤为过滤、______、灼烧、冷却、称量。
c. 下列操作会导致所测定的铁元素含量偏高的是__。
A.步骤③所加氨水量不足 B.步骤④洗涤不充分 C.步骤④灼烧不充分
d. 写出步骤③中发生的离子方程式_____________________________________
e、简述滤液中存在Fe3+的检验方法是:_______________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com