
【题目】进行过滤操作应选用的一组仪器是( )
A. 滤纸、烧杯、试管夹、漏斗、玻璃棒
B. 烧杯、酒精灯、试管、漏斗
C. 漏斗、玻璃棒、烧杯、铁架台、滤纸
D. 玻璃棒、滤纸、烧瓶、漏斗、铁架台
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】氮是动植物生长不可缺少的元素,含氮化合物也是重要的化工原料。自然界中存在如下图所示的氮元素的循环过程,下列说法不正确的是
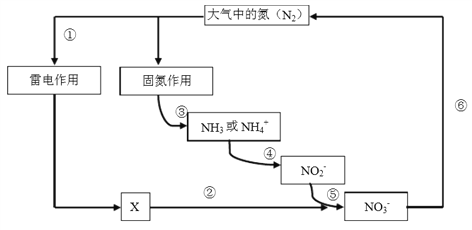
A. 过程①“雷电作用”中发生的反应是:N2 + O2 === 2NO
B. 过程③ “固氮作用”中,氮气被还原
C. ⑤中涉及的反应可能有: 2 NO2 + O2 === 2 NO3
D. ⑥中涉及的反应可能有: 2NO3- + 12H+ === N2+ 6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1molL﹣1 HCl的反应速率.
①该反应的离子方程式为 .
②设计实验方案:通过测量计算反应速率
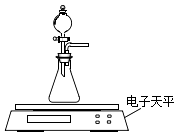
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1molL﹣1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①﹣⑥所代表的必要数据或物理量
物理量 | V(0.1molL﹣1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
实验1 | a | b | 0 | c | d | |
实验2 | 0 | c | d | |||
实验3 | c | 0 | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用的几种气体发生装置如图A、B、C所示:

(1)实验室可以用B或C装置制取氧气:
Ⅰ、如果用B装置,通常使用的药品是______;
Ⅱ、如果用C装置,通常使用的药品是______;
Ⅲ、检查B装置气密性的操作方法是______。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是____(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的____。
① CO2 ② H2 ③ Cl2
Ⅰ、写出A装置中反应的离子方程式并用单线桥标出电子转移方向和数目:____。
Ⅱ、D装置中小烧杯中应盛放____,目的是____。
Ⅲ、若要收集干燥纯净的X气体,上述装置应如何改进:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3性质的比较中,正确的是( )
A.等浓度的溶液中滴入稀盐酸,放出气体的快慢Na2CO3<NaHCO3
B.热稳定性Na2CO3<NaHCO3
C.常温时水溶性Na2CO3<NaHCO3
D.相对分子质量Na2CO3<NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有Mg2+、Al3+、Fe3+、Cu2+、NH4+、Na+中的一种或几种,取100mL该溶液,向其中不断滴加NaOH溶液,产生的沉淀随着NaOH体积变化的关系如图所示,则下列叙述不正确的是
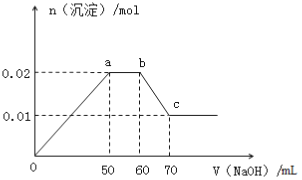
A. 该溶液中一定不含Fe3+、Cu2+
B. 该溶液中一定含有Mg2+、Al3+、NH4+,且三者物质的量浓度之比为1:1:2
C. 所加NaOH溶液物质的量浓度为1mol/L
D. a点到b点,NH4++OH- =NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A.ClO2﹣的空间构型为平面三角形
B.SiF4和SO32﹣的中心原子均为sp3杂化
C.在所有的元素中,氟的第一电离能最大
D.C2H5OH分子中共含有8个极性键,1个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟在自然界中常以CaF2的形式存在.
(1)下列关于CaF2的表述正确的是 .
a.Ca2+与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣ , 则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是(用离子方程式表示).
已知AlF63﹣在溶液中可稳定存在.
(3)F2通入稀NaOH溶液中可生成OF2 , OF2分子构型为 , 其中氧原子的杂化方式为
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等.已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1 , F﹣F键的键能为159kJmol﹣1 , Cl﹣Cl键的键能为242kJmol﹣1 , 则ClF3中Cl﹣F键的平均键能为kJmol﹣1 . ClF3的熔、沸点比BrF3的(填“高”或“低”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com