
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工业流程如下:
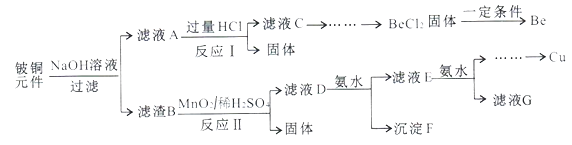
已知:i.铍、铝元素化学性质相似能形成BeO22-;ii.常温下部分难溶物的溶度积常数如下表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)用NaOH溶液溶解铍铜元件步骤中提高溶解率的措施是_______。(至少写出两种)滤液A的主要成分除NaOH外,还有_____(填化学式)。
(2)写出反应I中含铍化合物与过量盐酸反应的离子方程式_______,写出反应I中生成固体的化学方程式:________。
(3)滤液C中含NaCl、BeCl2和少量HCl。为提纯BeCl2,最合理的实验步骤顺序为____(填字母)。
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH
d.加入适量的HCl e.洗涤 f.过滤
(4)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS发生反应的化学方程式:______。
(5)该小组从1kg该种旧铍铜元件中回收得到433g Cu,则该流程Cu的产率为_______(保留三位有效数字)。
【答案】搅拌、升温加热、将元件研磨成粉末、增加碱液的浓度(写出两种即可) Na2BeO2、Na2SiO3 BeO22-+4H+=Be2++2H2O Na2SiO3+2HCl=2NaCl+H2SiO3↓ afed 2H2SO4+CuS+MnO2=S+MnSO4+CuSO4+2H2O 91.5%
【解析】
废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2),加入氢氧化钠溶液反应后过滤,根据题目信息可知BeO属于两性氧化物,CuS不与氢氧化钠溶液反应,FeS不与氢氧化钠溶液反应,二氧化硅属于酸性氧化物,和氢氧化钠溶液反应生成硅酸钠和水,因此滤液A成分是NaOH、Na2SiO3、Na2BeO2,滤渣B为CuS、FeS,滤液中加入过量盐酸过滤得到固体为硅酸,溶液中为BeCl2,向溶液C中先加入过量的氨水,生成Be(OH)2沉淀,然后过滤洗涤,再加入适量的HCl生成BeCl2,在HCl气氛中对BeCl2溶液蒸发结晶得到晶体,滤渣B中加入硫酸酸化的二氧化锰,MnO2能将金属硫化物中的硫元素氧化为单质硫,酸性介质中二氧化锰被还原为锰盐,过滤得到溶液D为硫酸铜、硫酸铁、硫酸锰的混合溶液,逐滴加入稀氨水调节pH可依次分离,最后得到金属铜。
(1)用NaOH溶液溶解铍铜元件,BeO、SiO2与NaOH溶液发生反应,而CuS、FeS不能反应,步骤中提高溶解率的措施有将元件研磨成粉末、增加碱液的浓度、搅拌、升温加热等。所以滤液A的主要成分除NaOH外,还有BeO、SiO2与NaOH溶液发生反应产生的Na2BeO2、Na2SiO3。
(2)反应I中得到的含铍化合物Na2BeO2与过量盐酸反应产生BeCl2和水,反应的离子方程式为BeO22-+4H+=Be2++2H2O,Na2SiO3则会与HCl发生复分解反应产生难溶性的硅酸和NaCl,所以反应I中生成固体的化学方程式:Na2SiO3+2HCl=2NaCl+H2SiO3↓。
(3)①利用铍、铝元素处于周期表中的对角线位置,化学性质相似,向溶液C中先加入过量的氨水,生成Be(OH)2沉淀,然后过滤洗涤,再向沉淀物中加入适量的HCl生成BeCl2,故合理的步骤为:afed;
(4)MnO2能将金属硫化物中的硫元素氧化为单质硫,酸性介质中二氧化锰被还原为锰盐,反应Ⅱ中CuS发生反应的化学方程式为:2H2SO4+CuS+MnO2=S+MnSO4+CuSO4+2H2O;
(5)混合物中CuS 含量是71%,则1kg该种旧铍铜元件中含有CuS的质量是1000×71%=710g,理论上得到Cu的质量是![]() =473.3g,实际得到Cu质量是433g,所以该流程Cu的产率为
=473.3g,实际得到Cu质量是433g,所以该流程Cu的产率为![]() =91.5%。
=91.5%。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】常温下,H2C2O4的电离常数:Ka1=5.4×10-2,Ka2=5.0×10-5。在V1mL0.1molL-1H2C2O4溶液中滴加0.1molL-1KOH溶液,混合溶液中水电离的c水(H+)与KOH溶液体积V的关系如图所示。下列说法正确的是( )
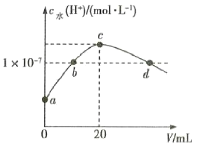
A.V1=20mL
B.b点和d点对应的溶液中都存在:c(K+)=c(HC2O4-)+2c(C2O42-)
C.常温下,加水稀释b点对应的溶液,稀释后溶液pH减小
D.常温下,KHC2O4的Kh1=2×10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
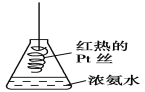
【题目】探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是( )
A. 将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水
B. 向氨水中加入浓氢氧化钠溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,说明氨水中含有NH4+
C. 加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3具有热不稳定性
D. 将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量的红棕色气体,说明氨气催化氧化的产物中有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A.酸性:![]()
B.热稳定性:Na2 CO3![]() NaHCO3
NaHCO3
C.与水反应的速率:Na![]() Mg
Mg
D.非金属性:Cl![]() Br
Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是
A | B | C | D |
|
|
|
|
制取Cl2 | 使Br-转化为Br2 | 分离出溴的苯溶液 | 将分液后的水层蒸干获得无水FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列说法正确的是( )
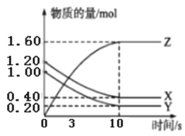
A.该反应的化学方程式为3X+Y![]() 2Z
2Z
B.3s时,正逆反应速率相等
C.平衡时X的浓度为0.40mol/L
D.10s时,该反应达到了最大限度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g) ![]() N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
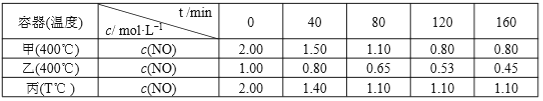
A.达到平衡状态时,2v 正(NO)= v 逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为 v (NO) >0.01125mol·L-1·min-1
D.由表格数据可知:T<400℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为几种化合物的元素组成示意图,以下说法错误的是

A. 若①为某种具有催化作用的化合物,则其水解产物为氨基酸
B. 若②为脂肪,则其大量积累于皮下和内脏器官周围
C. 若③为蓝藻的遗传物质,则其和蛋白质组成染色体
D. 若④为糖原,则其主要分布在人和动物的肌肉和肝脏中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com