
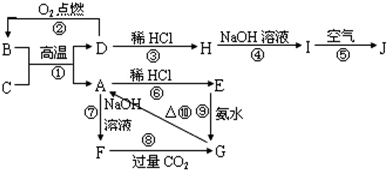
| ||
| ||


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18 | B、20 | C、22 | D、24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从氢核磁共振谱图上可以定量的分析出有机物中处于不同化学环境的氢原子的种类和比例 |
| B、红外光谱可以定性分析有机物中具有哪些基团或化学键 |
| C、李比希元素分析法能测得有机物中所有元素的质量分数 |
| D、钠熔融法和铜丝燃烧法都是定性检验有机物中某些特定元素的分析方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mo1?L-1的Na2CO3溶液中:c(OH-)═c(HCO3-)+c(H+)+c(H2CO3) |
| B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3->c(CO32-)>c(H2CO3) |
| D、一定量(NH4)2SO4与NH3?H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
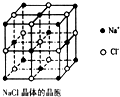 纳米材料的表面微 粒占总微粒数的比例极大,这是它有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数与总微粒数的比值为( )
纳米材料的表面微 粒占总微粒数的比例极大,这是它有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状相同(如图所示),则这种纳米颗粒的表面微粒数与总微粒数的比值为( )| A、7:8 | B、13:14 |
| C、25:26 | D、26:27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向正极移动 |
| C、充电时每转移3mol电子,阳极有1molFe(OH)3被还原 |
| D、充电时阳极反应式为:3Zn(OH)2+6e-═3Zn+6OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com