
【题目】合金是一类用途广泛的金属材料。下列物质中,不属于合金的是( )
A. 不锈钢 B. 青铜 C. 硬铝 D. 水银
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)写出表示含有8个质子、8个中子的原子的化学符号: . 其在周期表中的位置为第周期族.
(2)元素周期表中最活泼的非金属元素位于第纵行.
(3)在NaCl、NaOH、N2、H2S中,只含有极性键的是 , 只含有离子键的是 , 既含有极性键又含有离子键的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,99 ml 0.1 mol/L盐酸和101 ml 0.05 mol/L氢氧化钡溶液相混和(忽略混合后溶液的体积变化),则混合后溶液的pH值为( )
A. 1.7 B. 10.7 C. 11 D. 11.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____和____(填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____(填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
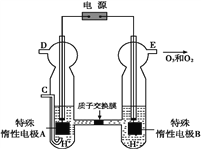
①图中阴极为____(填“A”或“B”),其电极反应式为_________________________。
②若C处通入O2,则A极的电极反应式为________,右室pH变化___________(填升高、降低、不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式按要求书写正确的是( )
A. 向NH4Al(SO4)2溶液中滴入少量NaOH溶液:Al 3++3OH= A l(OH)3↓
B. 从酸化的海带灰浸出液中提取碘:2I+H2O2 = I2+2OH
C. 向含有0.1mol NaOH和0.1mol Na2CO3的溶液中加入1L 0.4mol/L的稀盐酸OH+CO32+3H+ = CO2↑+2H2O
D. 明矾净水是因为产生Al(OH)3胶体:Al3++3H2O=== A l(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.01mol的铁、铝混合物溶于100mL 0.2mol/LH2SO4溶液中,然后再滴加1mol/L NaOH溶液.若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示.当V1=16mL时,则V2为( ) 
A.24mL
B.30mL
C.440mL
D.44mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业与人类的生产生活息息相关,回答下列问题:
已知反应: Fe(s)+CO2(g) ![]() FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
FeO(s)+CO(g) △H =a kJmol-1,测得在不同温度下,平衡常数 K 值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.40 |
(1)写出 K 的表达式__________________。
(2)反应中的 a____________0(填“>”、“<”或“=”)。
(3)若 500℃时进行反应,CO2 起始浓度为 3molL-1,CO 的平衡浓度为______molL-1。
(4)700 ℃时反应达到平衡,要使该平衡向右移动且能增大 CO2(g)的转化率,其他条件不变时,可以采取的措施有________(填序号)。
A.升高温度到 900 ℃ B.通入 CO2
C.增加 Fe 的量 D.使用合适的催化剂
(5)700℃反应达到平衡,此时增大反应中 CO 的浓度,该平衡移动后达到新的平衡,其它条件不变时,CO 和 CO2 的体积比值__________(填“增大”、“减小”或 “不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某2L恒容密闭容器中充入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+Y(g)![]() 3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g),反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
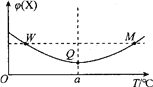
A. M点时,Y的转化率最大
B. 升高温度,平衡常数减小
C. W、M两点Y的正反应速率W大
D. W、M两点Y的正反应速率相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com