
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是____和____(填分子式)。
(2)已知①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) =CO(g)+ H2(g)ΔH2=+131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则反应CH4(g)=C(s)+2H2(g)的ΔH=_______________kJ·mol–1
(3)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
pH t /min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的微粒是____。
②在30 ℃、pH=4.0条件下,O3的分解速率为_____mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为_____(填字母)。
a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(4)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
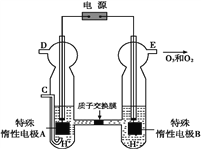
①图中阴极为____(填“A”或“B”),其电极反应式为_________________________。
②若C处通入O2,则A极的电极反应式为________,右室pH变化___________(填升高、降低、不变)
【答案】 I2 O2 +74.8 OH- 1.00×10-4 b、a、c A 2H++2e-=H2↑ O2+4H++4e-=2H2O 降低
【解析】(1)O3与KI溶液反应生成的两种单质,根据原子守恒可知应该是I2、O2。(2)已知
①2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6kJ·mol–1
②C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3kJ·mol–1
③CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH3=+206.1kJ·mol–1
则根据盖斯定律可知③-②即得到反应CH4(g)=C(s)+2H2(g)的焓变ΔH=+74.8kJ·mol–1;
(3)①pH增大能加速O3分解,pH越大,氢氧根浓度越大,所以表明对O3分解起催化作用的微粒是OH-。②根据表中数据可知在30℃、pH=4.0条件下,O3的分解速率为=0.0108mol/L÷108min=1.00×10-4mol/(Lmin);③由表中数据可知,40℃、pH=3.0时,所需时间在31min~158min之间;10℃、pH=4.0时,所需时间>231min;30℃、pH=7.0时,所需时间<7min,则分解速率依次增大的顺序为b、a、c;(4)①由图可知,B极生成O2、O3,B极发生氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-=H2↑;②C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O;右室氢氧根放电,破坏水的电离平衡,氢离子浓度增大,pH降低。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一小块金属钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是( )
①变成白色粉末 ②变暗 ③变成白色固体 ④变成液体
A. ①②③④ B. ②③④① C. ②③①④ D. ③②④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O三种元素,其蒸气密度是相同条件下CH4密度的3.625倍,把1.16g该有机物在O2中充分燃烧,将生成物通过足量碱石灰,碱石灰增重3.72g,又知生成的CO2和H2O的物质的量之比为1:1.该有机物可以使溴水褪色,能和金属钠发生反应生成H2.求:
(1)该有机物的摩尔质量
(2)该有机物的分子式
(3)该有机物的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器 中发生反应 aA(g) +bB(s) ![]() cC(g)+dD(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时,D 的浓度为原平衡的 1.7 倍,下列判断正确的是()
cC(g)+dD(g),反应达到平衡后,保持温度不变,将气体体积压缩到原来的一半,当再次达到平衡时,D 的浓度为原平衡的 1.7 倍,下列判断正确的是()
A. a+b < c+d B. D 的物质的量增加
C. A 的转化率变小 D. 平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将装有60mLNO2、NO混合气的量筒倒立于水槽中,反应后气体体积缩小为40mL,则混合气体中NO2和NO的体积比是( )
A.5:3
B.2:3
C.1:1
D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种来自石油的重要的有机化工原料,是衡量一个国家石油化工生产水平的标志;E是一种具有果香味的有机物,F是一种高聚物,可制成多种包装材料。(过程中的水或其他物质已省略)

(1)写出反应①的化学方程式_________________________________;反应类型____________;
(2)写出反应B+D→E的化学方程式___________________________反应类型___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种重要的化工原料,请回答下列问题:
I.高铁酸钾(K2FeO4)溶液呈紫红色,向其中加入过量亚硝酸钠后,溶液紫红色逐渐褪去,并出现红褐色沉淀,请写出该反应的离子方程式__________________。
I1.实验室模拟下图所示流程制备亚硝酸钠:

已知: ①氧化过程中,控制反应液温度在35~60℃条件下主要发生反应:
C6H12O6+ 12HNO3=3HOOC-COOH+9NO2↑+3NO↑+9H2O
②氢氧化钠溶液吸收NO 和NO2发生反应:
NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O

(1)木屑的主要成分是纤维素,结合已知信息①,你认为向木屑中加稀硫酸的作用是_____ ,氧化过程中反应温度不宜高于60℃,原因是______________。
(2)不做任何处理,按此过程进行,氢氧化钠溶液吸收后的溶液中除了OH-外还有两种阴离子,其中一种是NO2-,NO2-与另一种阴离子的物质的量之比为________。
(3)装置B用于制备NaNO2,盛裝的试剂除NaOH(aq)外,还可以是_____ (填字母)。
A.NaCl(aq) B.Na2CO3(aq) C.NaNO3( aq )
Ⅲ.测定产品纯度:
[实验步骤] ①准确称量ag 产品配成200mL溶液
②从步骤①配制的溶液中移取20.00mL 加入锥形瓶中
③用c mol/L酸性KMnO4溶液滴定至终点
④重复以上操作3 次,消耗酸性KMnO4溶液的平均体积为VmL
(1)锥形瓶中发生反应的离子方程式为____________。
(2)产品中NaNO2 的纯度为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com