
【题目】铅、二氧化铅、氟硼酸(HBF4)电池是一种低温性能优良的电池,常用于军事和国防工业,其总反应方程式为Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质],下列说法中不正确的是( )
2Pb(BF4)2+2H2O[已知:HBF4、Pb(BF4)2均是易溶于水的强电解质],下列说法中不正确的是( )
A. 放电时,溶液中的BF4-向负极移动
B. 放电时,转移1mol电子时正极减少的质量为119.5g
C. 充电时,阳极附近溶液的酸性减弱
D. 充电时,阴极的电极反应式为Pb2++2e-═Pb
【答案】C
【解析】试题分析:原电池的总反应为:Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极。A、放电时,此装置为原电池,阴离子BF4-要向负极移动,故A正确;B、放电时,正极反应:PbO2+2e-+4H+=Pb2++2H2O,每当转移2mol电子时正极有1molPbO2溶解,质量减少239g,故转移1mol电子时正极减少的质量为119.5g,故B正确;C、充电时,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,产生大量氢离子,故阳极附近溶液的酸性增强,故C错误;D、充电时的阴极反应即是将放电时的负极反应倒过来,故阴极反应为:Pb2++2e-=Pb,故D正确,故选C。
2Pb(BF4)2+2H2O,故放电时负极反应为:Pb-2e-=Pb2+;正极反应:PbO2+2e-+4H+=Pb2++2H2O,阴离子移向负极,阳离子移向正极;充电时,阴极反应:Pb2++2e-=Pb,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,阴离子移向阳极,阳离子移向阴极。A、放电时,此装置为原电池,阴离子BF4-要向负极移动,故A正确;B、放电时,正极反应:PbO2+2e-+4H+=Pb2++2H2O,每当转移2mol电子时正极有1molPbO2溶解,质量减少239g,故转移1mol电子时正极减少的质量为119.5g,故B正确;C、充电时,阳极反应:Pb2++2H2O-2e-=PbO2+4H+,产生大量氢离子,故阳极附近溶液的酸性增强,故C错误;D、充电时的阴极反应即是将放电时的负极反应倒过来,故阴极反应为:Pb2++2e-=Pb,故D正确,故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )

A. 在t℃时,Ag2CrO4的Ksp为1×10-8
B. 在饱和溶液中加入K2CrO4可使溶液由Y点到Z点
C. 在t℃时,Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
2AgCl(s)+CrO42-(aq)平衡常数K=6.25×107
D. 在t℃时,以0.001mol/L AgNO3溶液滴定20mL 0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现下列实验目的,下表提供的主要仪器和所用试剂合理的是( )
选项 | 实验目的 | 主要仪器 | 所用试剂 |
A | 提纯混有MgCl2杂质的AlCl3溶液 | 烧杯、分液漏斗、胶头滴管、铁架台 | 待提纯的AlCl3溶液、NaOH溶液 |
B | 检验NH4Cl固体中的阳离子 | 试管、酒精灯 | NH4Cl固体、红色石蕊试纸、蒸馏水 |
C | 实验室制取CO2 | 试管、带导管的橡胶塞 | 大理石、稀硫酸 |
D | 测定FeSO4溶液的浓度 | 酸式滴定管、锥形瓶、 烧杯 | 0.100 mol·L-1 KMnO4标准溶液、FeSO4溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是形成化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
(1)碳原子核外电子有_____种不同的运动状态。碳原子的价电子在形成sp3杂化后,其轨道表达式为_____。
(2)写出一种CO32-的等电子体微粒的化学式_______,其空间构型为_______。
(3)有机物M(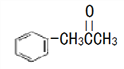 )在一定条件下生成N(
)在一定条件下生成N( )。
)。
①沸点:M_____N (填“大于”或“小于”)。
②M中碳原子杂化类型为_____,不同杂化类型的碳原子数之比为_____。
③有机物N中除氢原子之外的其他原子的第一电离能由大到小的顺序为_____。
(4)已知CaCO3的热分解温度为900℃,SrCO3的热分解温度为1172℃,试从原子结构的角度解释CaCO3的热分解温度低于SrCO3的原因_____________。
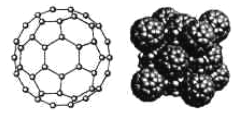
(5)碳的一种同素异形体C60,又名足球烯,是一种高度堆成的球碳分子。立方烷(分子式:C8H8,![]() )是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。
)是比C60约早20年合成出的一种对称性烃类分子,而如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如下图所示,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体的组成用二者的分子式可表示为______________。
(6)石墨是碳的一种同素异形体,它的一种晶胞结构和部分晶胞参数如下图:
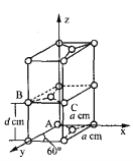
①原子坐标参数描述的是晶胞内原子间的相对位置。石墨晶胞中碳原子A、B的坐标参数分别为:A(0,0,0)、B(0,1,1/2)。则C原子的坐标参数为_______________。
②晶胞参数用以描述晶胞的大小和形状。已知石墨晶胞底边长为acm ,层间距为dcm,阿伏加德罗常数的值为NA,则石墨的密度为_____g·cm-3(写出表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子和分子是粒子存在的两种重要形式,一些粒子在人的生理活动中发挥着重要的作用。下列常见的粒子中,没有还原性的是( )
A.Cl-B.Na+C.N2D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如图所示,下列叙述不正确的是
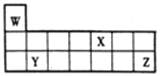
A. 原子半径:Y>Z>W
B. Z的氧化物对应的水化物酸性均比X的强
C. W、X、Z三种元素形成的化合物可能既含离子键又含共价键
D. 单质的熔点:Y>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
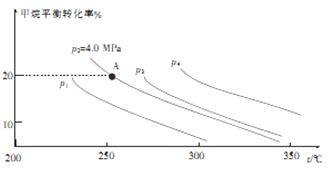
该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。
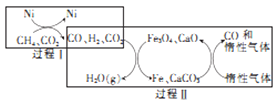
①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学与科研、生产、生活相关的说法不正确的是( )
A.84消毒液能消杀新冠病毒,它也具有漂白性
B.常用铝槽车装运浓硫酸及浓硝酸是因为它们和铝不发生化学反应
C.锂离子电池是新一代可充电的绿色电池
D.电力是污染最小的一种二次能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com