
【题目】下列数据是一些有机物的相对分子质量,可能为同系物的一组是( )
A.16,32,46,60 B.16,30,42,56 C.16,28,40,52 D.16,30,58,72
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是
A. 0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B. pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
C. pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液,NH4+大小顺序为①=②>③
D. 0.2 mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(H+)>c(Al3+)>c(OH-)
【答案】C
【解析】根据质子守恒,0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故A错误;根据电荷守恒,NaF溶液中[c(Na+)-c(F-)]= [c(OH-)-c(H+)],CH3COOK溶液[c(K+)-c(CH3COO-)]= [c(OH-)-c(H+)],PH相等,所以[c(Na+)-c(F-)]=[c(K+)-c(CH3COO-)],故B错误; NH4Cl、(NH4)2SO4由于NH4+水解溶液呈酸性,pH相等,所以NH4+浓度相等,NH4HSO4溶液主要由于NH4HSO4电离呈酸性,所以NH4HSO4溶液中NH4+浓度最小,故C正确;0.2 mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混,完全反应生成氯化钠、氯化铝、氢氧化铝,所以c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-),故D错误。
【题型】单选题
【结束】
8
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。某化学兴趣小组进行如下有关SO2性质和含量测定的探究活动。

(1)装置A中仪器a的名称为________。写出A中发生反应的离子方程式_________________________。若利用装置A中产生的气体证明+4价的硫元素具有氧化性,试用化学方程式表示该实验方案的反应原理_______________________________________。
(2)选用图中的装置和药品探究亚硫酸与次氯酸的酸性强弱:
①甲同学认为按A→C→F→尾气处理顺序连接装置可以证明亚硫酸和次氯酸的酸性强弱,乙同学认为该方案不合理,其理由是__________________________________。
②丙同学设计的合理实验方案为:按照A→C→______→F→尾气处理(填字母)顺序连接装置。证明亚硫酸的酸性强于次氯酸的酸性的实验现象是____________________________。
③其中裝置C的作用是____________________________。
(3)为了测定装置A残液中SO2的含量,量取10.00mL残液于圆底烧瓶中,加热使SO2全部蒸出,用20.00mL0.0500mol·L-1的KMnO4溶液吸收。充分反应后,再用0.2000 mol·L-1的KI标准溶液滴定过量的KMnO4,消耗KI溶液20.00mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+ 10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①残液中SO2的含量为____g·L-1。
②若滴定前读数时平视,滴定终点读数时俯视则测定结果________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)海洋资源的利用具有广阔前景。
(1)下图是从海水中提取镁的简单流程:

①从悬浊液中将Mg(OH)2分离出来的操作名称为_____________。
②Mg(OH)2转化为MgCl2的离子方程式是_____________。
③由无水MgCl2制取Mg的化学方程式是_____________。
(2)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:

①灼烧所用仪器是下列中的哪一种_____________(填字母序号)。
a. 蒸发皿 b. 坩埚 c. 烧杯
②向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2,请写出该反应的离子方程式:__________________________。
③上述反应结束后,可加入萃取剂,采用萃取一分液的方法从碘水中提取碘。下列试剂中可以用于萃取碘单质的是_____________(填字母序号)。
a. 乙酸 b. 四氯化碳 c. 硝酸 d. 苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是

A. 加入Na2SO4可使溶液由a点变到b点
B. 通过蒸发可以使溶液由d点变到c点
C. d点无BaSO4沉淀生成
D. a点对应的Ksp大于c点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯在化工生产领域应用广泛。
(1)乙烯能合成很多有实用价值的有机物。

①试剂a是_____________。
②反应Ⅰ的反应类型是_____________。
(2)以原油为起始原料合成聚乙烯的路线如下图所示。

①聚乙烯的结构简式是_____________。
②写出分子式符合C4H10的有机物的结构简式_____________。
(3)已知:CH3CHO![]() CH3COOH。以CH2=CH2为起始原料,选用必要的无机试剂合成乙酸乙酯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
CH3COOH。以CH2=CH2为起始原料,选用必要的无机试剂合成乙酸乙酯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下0.1mol/L的NH4HCO3溶液pH =7.8, 已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是
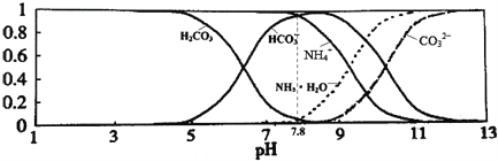
A. 溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
B. NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
C. 通过分析可知常温下 :Kb(NH3·H2O)<Ka1(H2CO3)
D. 在此溶液中滴加少量浓盐酸,溶液中c(CO32-) / c(HCO3-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属氧化物的说法不正确的是( )
A.Fe3O4是具有磁性的黑色晶体
B.Al2O3能溶于酸和强碱,是两性氧化物
C.Na2O是碱性氧化物,可与H2O、CO2反应
D.FeO不稳定,在空气中受热迅速被氧化为Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池广泛用作便携式电源,其正极材料是决定锂离子电池可逆容量与循环寿命的关键因素之一。锂二次电池一般以LiCoO2、LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LPF6、LiBF4等的碳酸二乙酯(DEC)为电解液。充电时,Li+从正极层状氧化物的晶格间脱出进入有机电解液,有机电解液中的Li+则进入负极,得电子后以原子形式嵌入到石墨材料的晶格中,即:6C+xLi++xe-=LixC6,如图所示:

(1)如图所示,已知该电池电极总反应:LiCoO2+C![]() Li1-xCoO2+CLix,充电时,该电池的正极上的反应为_______________________。
Li1-xCoO2+CLix,充电时,该电池的正极上的反应为_______________________。
(2)放电时负极材料质量________(填“增加”、“减小”或“不变”)
(3)在实验室中,可用下列方案从废旧锂离子电池的正极材料中(主要含有LiCoO2、炭粉及少量Al、Fe等)回收钴和锂。
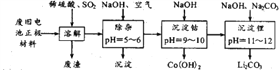
①溶解过程中,通入SO2时所发生反应的化学方程式为________________________;
②除杂过程中,所得沉淀的主要成分是___________________;(写化学式)
③常温下,已知Ksp[Co(OH)2]=1.09×10-15,若沉淀钴时pH=9.5,则溶液中Co2+是否沉淀完全?请列式计算说明。 _______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com