
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ��ϣ�����Ȼ��ɰΪ��ʼ�����һϵ�з�Ӧ���Եõ�BF3��BN������ͼ��ʾ��
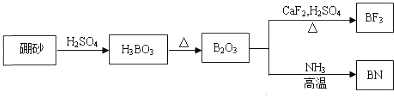
��ش��������⣺
����B2O3�Ʊ�BN�Ļ�ѧ����ʽ��_______��
�ƻ�̬Bԭ�ӵĵ����Ų�ʽΪ_____��B��N��ȣ��縺�Խϴ����_____��BN��BԪ�صĻ��ϼ�Ϊ_____��
����BF3�����У�F-B-F�ļ�����_____��Bԭ�ӵ��ӻ��������Ϊ_____��BF3����NaF���ÿ�����NaBF4��![]() �����幹��Ϊ_____��
�����幹��Ϊ_____��
�ȵ��������ж��ֽṹ�������������������������ȡ�����������ṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5pm����������������ܶ���______________g��cm-3��ֻҪ������ʽ�����ؼ������ֵ�������ӵ�����ΪNA mol��1����
���𰸡�B2O3+2NH3 ![]() 2BN+3H2O 1s22s22p1 N +3 120�� sp2 ����������
2BN+3H2O 1s22s22p1 N +3 120�� sp2 ���������� 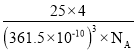
��������
��ɰ�����ᷴӦ����H3BO3��H3BO3���ȷֽ�õ�B2O3��B2O3��NH3 �ڸ����·�Ӧ����BN��H2O��B2O3�����ᡢ�����Ʒ�ӦBF3��ͬ���ڴ����ҵ縺�������������ʿռ乹�ͺ�����ԭ���ӻ���ʽʱһ���ȼ���۲���Ӷ����������ܶȹ�ʽ���м��㡣
��B2O3��NH3 �ڸ����·�Ӧ����BN��H2O���䷴Ӧ�Ļ�ѧ����ʽ��B2O3+2NH3 ![]() 2BN+3H2O���ʴ�Ϊ��B2O3+2NH3
2BN+3H2O���ʴ�Ϊ��B2O3+2NH3 ![]() 2BN+3H2O��
2BN+3H2O��
��B��5��Ԫ�أ���̬Bԭ�ӵĵ����Ų�ʽΪ1s22s22p1��ͬ���ڴ����ҵ縺�����������B��N��ȣ��縺�Խϴ����N��BN��NΪ3�ۣ�BԪ�صĻ��ϼ�Ϊ+3�ۣ��ʴ�Ϊ��1s22s22p1��N��+3��
��BF3��B�۲���Ӷ���Ϊ![]() ���ռ乹��Ϊƽ���������Σ���BF3�����У�F-B-F�ļ�����120����Bԭ�ӵ��ӻ��������Ϊsp2��BF3����NaF���ÿ�����NaBF4��BF4����B�۲���Ӷ���Ϊ
���ռ乹��Ϊƽ���������Σ���BF3�����У�F-B-F�ļ�����120����Bԭ�ӵ��ӻ��������Ϊsp2��BF3����NaF���ÿ�����NaBF4��BF4����B�۲���Ӷ���Ϊ![]() �������幹��Ϊ���������Σ��ʴ�Ϊ��120����sp2�����������Ρ�
�������幹��Ϊ���������Σ��ʴ�Ϊ��120����sp2�����������Ρ�
������������ṹ����ʯ���ƣ����ʯ����8��̼ԭ�ӣ�����������������4��BN�������߳�Ϊ361.5pm����������������ܶ���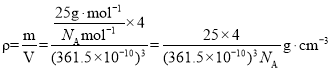 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 ��ѧ�̸̳����¿α�ϵ�д�
��ѧ�̸̳����¿α�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��������������������е���ҪԪ�ء�
��1��Ѫ�쵰��(Hb)�е���Ԫ�س������ۣ�����O2���ӽ�ϳ�����Ѫ�쵰��(HbO)�Ӷ�����������������NaNO2�������������ʹѪ�쵰��ɥʧ��O2���������ҩƷ����������Ч�Ľⶾ�����ⶾʱ��������_____��Ӧ(����������������ԭ��)��
��2����ͨ������ˮ�����ڸ����·�Ӧ��������ij�����������������������������ڸ����·����淴Ӧ�õ������������� ������������һ�ּ�ϸ�����ۣ����ڿ����п�����ȼ����ԭ����_____________��
����1 L 2 mol��L��1ϡ������Һ���������ۣ���Ӧ��������������ʵ�����������۵����ʵ����Ĺ�ϵ��ͼ��ʾ��
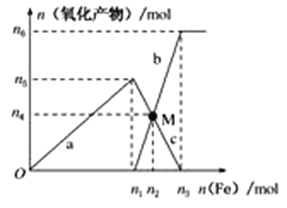
�ش��������⣺
��1��д������n1mol����������Ӧ�����ӷ���ʽ_______________________________��
��2������������ת�Ƶ��ӵ���Ŀ��________��
��3����M��ʱ�ټ���V L 2 mol��L��1��ϡ���ᣬǡ�÷�Ӧ��ȫ����VΪ___________��
��4���о����������Ũ��ԽС����Ӧ�Ļ��ϼ�Խ�͡��ڼ�ϡ��������Һ�м����������ۣ�����NH4�������ӷ���ʽΪ___________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¡���ѹ�£�1molA��1molB��һ���ݻ��ɱ�������з�����Ӧ��A(g)+2B(g)![]() 2C(g)��һ��ʱ���ﵽƽ�⣬����amolC������˵������ȷ���ǣ� ��
2C(g)��һ��ʱ���ﵽƽ�⣬����amolC������˵������ȷ���ǣ� ��
A.��ʼʱ�ʹﵽƽ��ʱ�����е�ѹǿ֮��Ϊ1��1
B.ƽ��ʱ����A��B��ת����֮��Ϊ1��2
C.ƽ��ʱA��ת����Ϊ![]()
D.��v��(A)=v��(B)ʱ�����ж���Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij100mL���Һ�У�HNO3��H2SO4�����ʵ���Ũ�ȷֱ���0.4mol/L��0.1mol/L����û��Һ�м���1.92gͭ�ۣ����ȣ�����ַ�Ӧ��������Һ�е�Cu2+�����ʵ���Ũ����( )mol/L
A. 0.15 B. 0.225 C. 0.35 D. 0.45
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ʵ����ͼ��װ��̽����ҵ����ϩ��ԭ������ϩ����Ҫ��ѧ���ʣ���ͼ��װ��̽������Һ��ķ�Ӧ����ش��������⣺
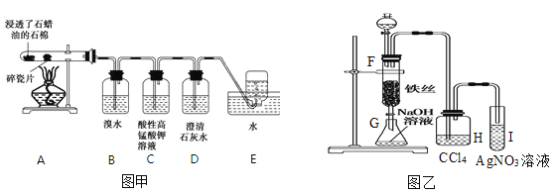
(1)��ҵ����ϩ��ʵ��ԭ��������(Һ̬)�ڴ����ͼ��������·�����Ӧ���ɲ���������
���磺ʯ�ͷ������֮һ��ʮ������������Ӧ�� C16H34 ![]() C8H18���ף���
C8H18���ף���![]() 4�ң���ķ���ʽΪ________���ҵĽṹ��ʽΪ_____________��
4�ң���ķ���ʽΪ________���ҵĽṹ��ʽΪ_____________��
(2)Bװ���е�ʵ�����������_____��д����Ӧ�Ļ�ѧ����ʽ��_____���䷴Ӧ������____��
(3)ʵ�鷴Ӧ��Ϻ�I�Թ��е�������__________��
(4)����������ϩ�ķ�����________(ѡ����ĸ��ͬ)����ȥ��������ϩ�ķ�����__________��
A������ͨ��ˮ�� B������ͨ��ʢ��ˮ��ϴ��ƿ C������ͨ��ʢ���Ը��������Һ��ϴ��ƿ D������ͨ������������Һ
(5)������ϩ�ͱ�������д�����·�Ӧ�Ļ�ѧ����ʽ��
����ϩ�������� ��__________________�� �ɱ��������� ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ,�ش��������⣺
��2H2��g��+O2��g��=2H2O��l�� ��H=��570kJ![]()
��2H2O��g��=2H2��g��+O2��g�� ��H=+483.6kJ![]()
��2C��s��+O2��g��=2CO��g�� ��H=��220.8kJ![]()
��C��s��+O2��g��=CO2��g�� ��H=��393.5kJ![]()
��1��������Ӧ�����ڷ��ȷ�Ӧ����_____����д��ţ���
��2��H2��ȼ����Ϊ_____��
��3��ȼ��8g H2����Һ̬ˮ���ų�������Ϊ_____��
��4��H2O��l��=H2O��g����H=______��
��5��CO��ȼ���ȵ��Ȼ�ѧ����ʽΪ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£������Ϊ2L�ĺ����ܱ������������������м���1molCO��2mol![]() �������м���2molCO��4mol
�������м���2molCO��4mol![]() �����������з�Ӧ������ƽ�⣺
�����������з�Ӧ������ƽ�⣺![]()
![]() ����ò�ͬ�¶���COƽ��ת������ͼ��ʾ������˵����ȷ����
����ò�ͬ�¶���COƽ��ת������ͼ��ʾ������˵����ȷ����![]()
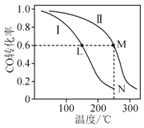
A.�����������Ϣ�����ƶϸ÷�Ӧ��![]()
B.��Ӧ��L��M����������ѹǿ��![]()
C.���Լ�����÷�Ӧ����N��ʱ����ѧƽ�ⳣ��ԼΪ![]()
D.��N��ƽ����ϵ���ټ���1mol![]() ����ƽ��ʱ������������С��
����ƽ��ʱ������������С��![]() mol
mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ���������Ϊ��Լ������ᾭ�÷�չ��ƿ����Խ��Խ��Ĺ��ҿ�ʼʵ��������ƻ���������̫������Դ��Ѱ�÷�չ���¶�����
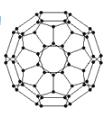
�Ÿ���ϩ���������ھ������õĹ�����ܣ���̫���ܵ�ص�Ӧ���Ͼ��зdz�������ǰ;������ϩ��C60���Ľṹ��ͼ��ʾ��������̼ԭ�ӹ�����ӻ�����Ϊ___��1 mol C60��������������ĿΪ____����
�ƶ�Ԫ�����ﱡĤ̫���ܵ�ز���Ϊ���Σ�����Ҫ�����黯�أ�GaAs�������ӣ�CdS����Ĥ��صȡ�
��һ������:As____Se������>����<������=������������____________��
������������NF3����һ����ɫ����ζ�����Ҳ���ȼ�����壬��̫���ܵ�������еõ��㷺Ӧ�á���֪NF3��NH3�Ŀռ乹�Ͷ��������Σ�NH3����Cu2+�γ������ӣ���NF3������Cu2+�γ������ӣ���ԭ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧΪ��̽��п�����ᷴӦ�����е����ʱ仯������100mLϡ�����м���������п�ۣ�����ˮ�������ռ���Ӧ�ų����������������������Ϊ��״���µ��������ʵ���¼���£��ۼ�ֵ����
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
�������/mL | 50 | 120 | 232 | 290 | 310 |
��1����Ӧ��������ʱ�����__������0��1min����1��2min����2��3min������4��5min������ԭ����__��
��2����Ӧ������С��ʱ�����__������0��1min����1��2min����2��3min������4��5min������ԭ����__��
��3��2��3minʱ����ڣ��������Ũ�ȱ仯��ʾ�÷�Ӧ������Ϊ__��
��4�������Ӧ̫���ң�Ϊ�˼�����Ӧ���ʶ��ֲ����ٲ���������������ͬѧ�������зֱ��������������Һ�壬����Ϊ���е���__������ţ���
A.����ˮ B.NaCl��Һ C.Na2CO3��Һ D.CuSO4��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com