
����Ŀ����Դ���������Ϊ��Լ������ᾭ�÷�չ��ƿ����Խ��Խ��Ĺ��ҿ�ʼʵ��������ƻ���������̫������Դ��Ѱ�÷�չ���¶�����
�Ÿ���ϩ���������ھ������õĹ�����ܣ���̫���ܵ�ص�Ӧ���Ͼ��зdz�������ǰ;������ϩ��C60���Ľṹ��ͼ��ʾ��������̼ԭ�ӹ�����ӻ�����Ϊ___��1 mol C60��������������ĿΪ____����
�ƶ�Ԫ�����ﱡĤ̫���ܵ�ز���Ϊ���Σ�����Ҫ�����黯�أ�GaAs�������ӣ�CdS����Ĥ��صȡ�
��һ������:As____Se������>����<������=������������____________��
������������NF3����һ����ɫ����ζ�����Ҳ���ȼ�����壬��̫���ܵ�������еõ��㷺Ӧ�á���֪NF3��NH3�Ŀռ乹�Ͷ��������Σ�NH3����Cu2+�γ������ӣ���NF3������Cu2+�γ������ӣ���ԭ����___________________��
���𰸡�sp2 90NA �� Asԭ��4p�������Ϊ��������ȶ��ṹ��Seԭ��4p�����4�����ӣ��ṹ���ȶ������Se��As��ʧȥһ��p���ӣ���һ�����ܣ�As��Se F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ������NF3������Cu2+�γ�������
��������
�Ÿ���ϩ�Ľṹ��һ����![]() ������ÿ��̼�ļۼ���
������ÿ��̼�ļۼ���
��ͬ���ڴ����ҵ�һ�����ܳ���������ƣ�����VA����ڵ�VIA�塣
�Ǹ��ݵ縺�ԶԵ��ӶԵ�������������
�Ÿ���ϩ�Ľṹ��һ����![]() ��ÿ��̼ԭ��������̼ԭ���γ�̼̼����������һ��̼ԭ���γ�̼̼˫������˷�����̼ԭ�Ӽ۲���Ӷ���Ϊ3+0 =3��̼ԭ�ӵ��ӻ�����Ϊ��sp2�ӻ������ݽṹÿ��̼ԭ����1��̼̼������0.5��̼̼˫�������1 mol C60��������60mol̼̼������30mol̼̼˫�������1mol C60��������������ĿΪ90NA����
��ÿ��̼ԭ��������̼ԭ���γ�̼̼����������һ��̼ԭ���γ�̼̼˫������˷�����̼ԭ�Ӽ۲���Ӷ���Ϊ3+0 =3��̼ԭ�ӵ��ӻ�����Ϊ��sp2�ӻ������ݽṹÿ��̼ԭ����1��̼̼������0.5��̼̼˫�������1 mol C60��������60mol̼̼������30mol̼̼˫�������1mol C60��������������ĿΪ90NA����
��ͬ���ڴ����ҵ�һ�����ܳ���������ƣ�����VA����ڵ�VIA�壬��˵�һ�����ܣ�As ��Se��������Asԭ��4p�������Ϊ��������ȶ��ṹ��Seԭ��4p�����4�����ӣ��ṹ���ȶ������Se��As��ʧȥһ��p���ӣ���һ�����ܣ�As��Se���ʴ�Ϊ��Asԭ��4p�������Ϊ��������ȶ��ṹ��Seԭ��4p�����4�����ӣ��ṹ���ȶ������Se��As��ʧȥһ��p���ӣ���һ�����ܣ�As��Se��
��NF3��NH3�Ŀռ乹�Ͷ��������Σ�NH3����Cu2+�γ������ӣ���NF3������Cu2+�γ������ӣ���ԭ����F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ������NF3������Cu2+�γ������ӣ��ʴ�Ϊ��F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3�е�ԭ�Ӻ˶���µ��ӶԵ�����������ǿ�������γ���λ������NF3������Cu2+�γ������ӡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
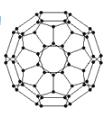
����Ŀ����������ʾ��ͼ,�����ж���ȷ����( )
A.��ѧ��Ӧ�жϼ�Ҫ�ų�����,�γɻ�ѧ��Ҫ��������
B.�÷�Ӧ�ķ�Ӧ��������С��������������
C.2A2(g)+B2(g)= 2C(g)��H=-(b+c-a)kJ��mol-1
D.��ͼ��֪,����1 mol C(l),�ų�![]() (b+c-a)kJ����
(b+c-a)kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
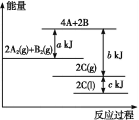
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ��ϣ�����Ȼ��ɰΪ��ʼ�����һϵ�з�Ӧ���Եõ�BF3��BN������ͼ��ʾ��
��ش��������⣺
����B2O3�Ʊ�BN�Ļ�ѧ����ʽ��_______��
�ƻ�̬Bԭ�ӵĵ����Ų�ʽΪ_____��B��N��ȣ��縺�Խϴ����_____��BN��BԪ�صĻ��ϼ�Ϊ_____��
����BF3�����У�F-B-F�ļ�����_____��Bԭ�ӵ��ӻ��������Ϊ_____��BF3����NaF���ÿ�����NaBF4��![]() �����幹��Ϊ_____��
�����幹��Ϊ_____��
�ȵ��������ж��ֽṹ�������������������������ȡ�����������ṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5pm����������������ܶ���______________g��cm-3��ֻҪ������ʽ�����ؼ������ֵ�������ӵ�����ΪNA mol��1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
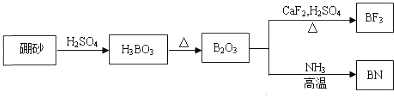
����Ŀ��ͭ����Ҫ������Cu�Ļ������ڿ�ѧ�о���ҵ�����о���������;����![]() ��Һ���������Һ�����Һ�ȣ���ش��������⣺
��Һ���������Һ�����Һ�ȣ���ش��������⣺
![]() ��ͭ����
��ͭ����![]() ��̬ʱ�ĺ�������Ų�ʽΪ ______
��̬ʱ�ĺ�������Ų�ʽΪ ______
![]() ����Ķѻ���ʽ�� ______ ������λ��Ϊ ______ ��
����Ķѻ���ʽ�� ______ ������λ��Ϊ ______ ��
![]() ������ͭ��Һ�м��������ˮ��������
������ͭ��Һ�м��������ˮ��������![]() ������˵����ȷ���� ______
������˵����ȷ���� ______
A.![]() �������Ļ�ѧ�������Ӽ������Լ�����λ��
�������Ļ�ѧ�������Ӽ������Լ�����λ��
B.��![]() ��
��![]() �����µ��Ӷԣ�
�����µ��Ӷԣ�![]() �ṩ�չ��
�ṩ�չ��
C.![]() ���Ԫ���е�һ��������������Ԫ��
���Ԫ���е�һ��������������Ԫ��
D.![]() ��
��![]() ��Ϊ�ȵ����壬�ռ乹�;�Ϊ��������
��Ϊ�ȵ����壬�ռ乹�;�Ϊ��������
![]() ��������ͭ�ķ��ӽṹ��ͼ��̼ԭ�ӵ��ӻ���ʽΪ______���÷�����
��������ͭ�ķ��ӽṹ��ͼ��̼ԭ�ӵ��ӻ���ʽΪ______���÷�����![]() ����
����![]() ��������ֵΪ ______
��������ֵΪ ______
![]() �ڹ������У�
�ڹ������У�![]() ������
������![]() ��ͼ
��ͼ![]() ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼbΪһ�����������ṹ�Ķ�������Si��O��ԭ����֮��Ϊ ______ ����ѧʽΪ ______ ��
ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼbΪһ�����������ṹ�Ķ�������Si��O��ԭ����֮��Ϊ ______ ����ѧʽΪ ______ ��
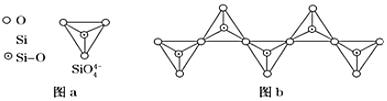
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ���ǣ� ��
A.2SO2 + O2![]() 2SO3 ��H= -196.6kJ/mol
2SO3 ��H= -196.6kJ/mol
B.N2(g)+2O2(g)=2NO2(g) ��H= +67.7kJ/mol
C.C(s)+O2(g)��CO2(g) ��H= +393.5kJ/mol
D.H2O��l��==H2��g����+1/2O2��g���� ��H= +285.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ���ܿ������齫�������̺�����������һ������ֽ�Ƴɵ���ֽͨ�����γɵ�أ���ͼ��ʾ���õ�ؿɽ����֣�pH=2.5���е���������Ϊȼ�ϲ�������������˵����ȷ���ǣ� ��
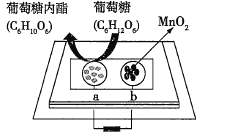
A.a������
B.���ŷ�Ӧ�Ľ��У���������pH��������
C.����0.1mol�����ǣ���·��ת��0.2mol����
D.b���ĵ缫��ӦʽΪMnO2+2H2O+2e-=Mn2++4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����������ȼ�ϵ�صĹ���ԭ����ͼ���õ�ط�ӦΪ��Mg+ClO��+H2O�TMg��OH��2+Cl�������й�˵����ȷ���ǣ�������
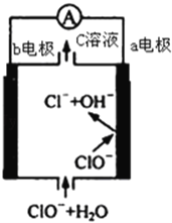
A. ��ع���ʱ��C��Һ�е�������MgCl2
B. ��ع���ʱ������a������pH����������
C. ������Ӧʽ��ClO����2e��+H2O�TCl��+2 OH��
D. b�缫������ԭ��Ӧ��ÿת��0.1mol���ӣ�����������0.1mol Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2(g)��F2(g)===2HF(g) ��H����270 kJ/mol������˵����ȷ����( )
A������������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ
B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ
C������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
D���÷�Ӧ�е������仯������ͼ����ʾ
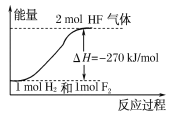
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�� 2CO(g)+O2(g)=2CO2(g)��H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)��H=-226kJ/mol
O2(g)��H=-226kJ/mol
���������Ȼ�ѧ����ʽ�жϣ�����˵����ȷ���ǣ� ��
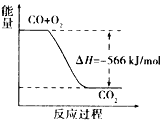
A. CO ��ȼ����Ϊ566kJ/mol
B. ��ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ��H<-452 kJ/mol
D. CO2(g)��Na2O2(s)��Ӧ�ų�452kJ ����ʱ������ת����Ϊ1.204��1024 (��)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com