
����Ŀ����֪�����Ȼ�ѧ����ʽ,�ش��������⣺
��2H2��g��+O2��g��=2H2O��l�� ��H=��570kJ![]()
��2H2O��g��=2H2��g��+O2��g�� ��H=+483.6kJ![]()
��2C��s��+O2��g��=2CO��g�� ��H=��220.8kJ![]()
��C��s��+O2��g��=CO2��g�� ��H=��393.5kJ![]()
��1��������Ӧ�����ڷ��ȷ�Ӧ����_____����д��ţ���
��2��H2��ȼ����Ϊ_____��
��3��ȼ��8g H2����Һ̬ˮ���ų�������Ϊ_____��
��4��H2O��l��=H2O��g����H=______��
��5��CO��ȼ���ȵ��Ȼ�ѧ����ʽΪ__��
���𰸡��٢ۢ� 285kJmol-1 1140kJ +43.2kJmol-1 CO��g��+![]() O2��g��=CO2��g����H=��283.1kJmol-1
O2��g��=CO2��g����H=��283.1kJmol-1
��������
�١�H��0ʱ��ӦΪ���ȷ�Ӧ���ʢ٢ܾۢ�Ϊ���ȷ�Ӧ��
�ʴ�Ϊ�٢ۢ�
��H2��ȼ������1 mol������ȫȼ�������ȶ�������Һ̬ˮʱ���ų�����������2H2��g��+O2��g��=2H2O��l����H=-570kJmol-1�����ݸ�˹����,������ȼ����Ϊ0.5����=285kJmol-1��
�ʴ�Ϊ285kJmol-1
��ȼ��8gH2����Һ̬ˮ���ų�������Ϊx�����������Ȼ�ѧ����ʽ���㣺
2H2��g��+O2 ��g��=2H2O��l������H=-570kJ?mol-1
4g 570KJ
8g x
x=1140KJ��
�ʴ�Ϊ1140KJ��
���ɸ�˹���ɵ�H2O��l��=H2O��g����H=��0.5���٣��ڣ�=+43.2kJmol-1
�ʴ�Ϊ+43.2kJmol-1
�����ݸ�˹���ɣ��ܡ�2-�ۣ���0.5�õ���CO��g��+![]() O2��g��=CO2��g����H= - 283KJ/mol
O2��g��=CO2��g����H= - 283KJ/mol
�ʴ�Ϊ��CO��g��+![]() O2��g��=CO2��g����H=-283KJ/mol��
O2��g��=CO2��g����H=-283KJ/mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ԫ��X��Y��Z��W��ԭ�������ֱ�Ϊ6��8��11��13����ش�
(1)д������Ԫ�ط���Z___________��
(2)д������Ԫ�������ڱ��е�λ��W_______________��
(3)д�����з�Ӧ����ʽ��X����������Y�����з�Ӧ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���ˮ��Һ��1molCl-��ClOx-(x=1��2��3��4)������(kJ)��Դ�С��ͼ��ʾ�������й�˵����ȷ���ǣ� ��
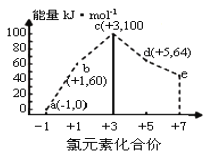
A.b��a+c��Ӧ�Ļ��Ϊ����������������Ӧ��������
B.b��a+d��Ӧ���Ȼ�ѧ����ʽΪ��3ClO-(aq)=ClO3-(aq)+2Cl-(aq) ��H=-116kJmol-1
C.a��b��c��d��e�У�c���ȶ�
D.һ���¶��£�Cl2��NaOH��Һ��Ӧ���ɵIJ�����a��b��d����Һ��a��b��d��Ũ��֮�ȿ���Ϊ11��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�������������������������һ�������¾��ܷ�����Ӧ����
�� | �� | �� | |
A |
| HCl | NaOH |
B |
| NaOH | HF |
C | HCl | NaOH |
|
D |
|
|
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ��ϣ�����Ȼ��ɰΪ��ʼ�����һϵ�з�Ӧ���Եõ�BF3��BN������ͼ��ʾ��
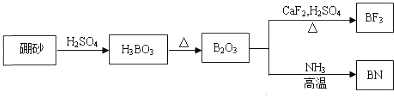
��ش��������⣺
����B2O3�Ʊ�BN�Ļ�ѧ����ʽ��_______��
�ƻ�̬Bԭ�ӵĵ����Ų�ʽΪ_____��B��N��ȣ��縺�Խϴ����_____��BN��BԪ�صĻ��ϼ�Ϊ_____��
����BF3�����У�F-B-F�ļ�����_____��Bԭ�ӵ��ӻ��������Ϊ_____��BF3����NaF���ÿ�����NaBF4��![]() �����幹��Ϊ_____��
�����幹��Ϊ_____��
�ȵ��������ж��ֽṹ�������������������������ȡ�����������ṹ����ʯ���ƣ�Ӳ������ʯ�൱�������߳�Ϊ361.5pm����������������ܶ���______________g��cm-3��ֻҪ������ʽ�����ؼ������ֵ�������ӵ�����ΪNA mol��1����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��5���л���ѧ����]
�۶Ա������ᶡ������(PBT)��һ����������������Ը߷��Ӳ��ϡ�PBT��һ�ֺϳ�·����ͼ��ʾ��
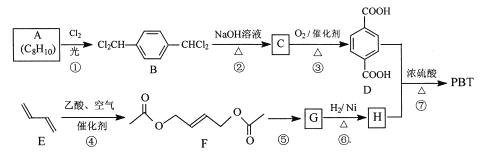
�ش��������⣺
(1)A�Ľṹ��ʽ��_________��C�Ļ�ѧ������_________��
(2)�ݵķ�Ӧ�Լ��ͷ�Ӧ�����ֱ���__________��
(3)F�ķ���ʽ��_________���ķ�Ӧ������_________��
(4)�ߵĻ�ѧ����ʽ��_________��
(5)M��H��ͬ���칹�壬ͬʱ����_��������M���ܵĽṹ��_________�֡�
a.0.1 molM�����������Ʒ�Ӧ��������2.24 L����״����
b.ͬһ��̼ԭ���ϲ�������2���ǻ�
���к˴Ź��������Բ�3��壬�ҷ����֮��Ϊ3��1��1�Ľṹ��ʽ��_________��
(6)��2һ��-1-3һ����ϩΪԭ�ϣ������Լ���ѡ��������Ʊ�![]() �ĺϳ�·�ߣ�_________
�ĺϳ�·�ߣ�_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
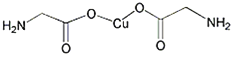
����Ŀ��ͭ����Ҫ������Cu�Ļ������ڿ�ѧ�о���ҵ�����о���������;����![]() ��Һ���������Һ�����Һ�ȣ���ش��������⣺
��Һ���������Һ�����Һ�ȣ���ش��������⣺
![]() ��ͭ����
��ͭ����![]() ��̬ʱ�ĺ�������Ų�ʽΪ ______
��̬ʱ�ĺ�������Ų�ʽΪ ______
![]() ����Ķѻ���ʽ�� ______ ������λ��Ϊ ______ ��
����Ķѻ���ʽ�� ______ ������λ��Ϊ ______ ��
![]() ������ͭ��Һ�м��������ˮ��������
������ͭ��Һ�м��������ˮ��������![]() ������˵����ȷ���� ______
������˵����ȷ���� ______
A.![]() �������Ļ�ѧ�������Ӽ������Լ�����λ��
�������Ļ�ѧ�������Ӽ������Լ�����λ��
B.��![]() ��
��![]() �����µ��Ӷԣ�
�����µ��Ӷԣ�![]() �ṩ�չ��
�ṩ�չ��
C.![]() ���Ԫ���е�һ��������������Ԫ��
���Ԫ���е�һ��������������Ԫ��
D.![]() ��
��![]() ��Ϊ�ȵ����壬�ռ乹�;�Ϊ��������
��Ϊ�ȵ����壬�ռ乹�;�Ϊ��������
![]() ��������ͭ�ķ��ӽṹ��ͼ��̼ԭ�ӵ��ӻ���ʽΪ______���÷�����
��������ͭ�ķ��ӽṹ��ͼ��̼ԭ�ӵ��ӻ���ʽΪ______���÷�����![]() ����
����![]() ��������ֵΪ ______
��������ֵΪ ______
![]() �ڹ������У�
�ڹ������У�![]() ������
������![]() ��ͼ
��ͼ![]() ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼbΪһ�����������ṹ�Ķ�������Si��O��ԭ����֮��Ϊ ______ ����ѧʽΪ ______ ��
ͨ�����ö��������ӿ��γɵ�״����״����״���Ǽ���״�Ĵ���ṹ��ʽ��ͼbΪһ�����������ṹ�Ķ�������Si��O��ԭ����֮��Ϊ ______ ����ѧʽΪ ______ ��
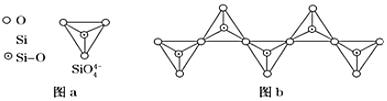
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ���ܿ������齫�������̺�����������һ������ֽ�Ƴɵ���ֽͨ�����γɵ�أ���ͼ��ʾ���õ�ؿɽ����֣�pH=2.5���е���������Ϊȼ�ϲ�������������˵����ȷ���ǣ� ��
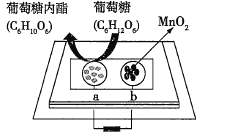
A.a������
B.���ŷ�Ӧ�Ľ��У���������pH��������
C.����0.1mol�����ǣ���·��ת��0.2mol����
D.b���ĵ缫��ӦʽΪMnO2+2H2O+2e-=Mn2++4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����֪��2L���ܱ������н������¿��淴Ӧ�������ʵ��й��������£�
aA(g) |
| bB(g) |
| 2C(g) | |
��ʼ���ʵ���Ũ��/(mol��L-1)�� | 1.5 | 1 | 0 | ||
2sĩ���ʵ���Ũ��/(mol��L-1)�� | 0.9 | 0.8 | 0.4 |
��ش��������⡣
�ٸÿ��淴Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ__��
��������B����ʾ0��2s��ƽ����Ӧ����Ϊ__��
�۴ӷ�Ӧ��ʼ��2sĩ��A��ת����Ϊ__��
��������ʵ�ܹ�˵��������Ӧ�ڸ��������Ѿ��ﵽ��ѧƽ��״̬����__������ţ�
A.vB�����ģ�=vC�����ɣ�
B.�������������ѹǿ���ֲ���
C.������������ܶȲ���
D.vA��vB��vC=3��1��2
E.����������C�����ʵ����������ֲ���
��2����п�����������Ǧ���أ����Ĺ��ɲ�����п��������ij�ֵ������Һ���������ܷ�Ӧ����ʽ��2Zn+O2=2ZnO����õ�صĸ���������__��
�����ASES��˾��Ƶ�����������DZͧ��Һ��-Һ��ȼ�ϵ�ص�ʾ��ͼ��ͼ����ȼ�ϵ�ع���ʱ����ص��ܷ�Ӧ����ʽΪ__�������ĵ缫��ӦʽΪ__��
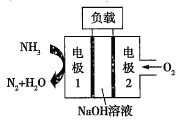
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com