
【题目】(1)已知在2L的密闭容器中进行如下可逆反应,各物质的有关数据如下:
aA(g) |
| bB(g) |
| 2C(g) | |
起始物质的量浓度/(mol·L-1): | 1.5 | 1 | 0 | ||
2s末物质的量浓度/(mol·L-1): | 0.9 | 0.8 | 0.4 |
请回答下列问题。
①该可逆反应的化学方程式可表示为__。
②用物质B来表示0~2s的平均反应速率为__。
③从反应开始到2s末,A的转化率为__。
④下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是__(填序号)
A.vB(消耗)=vC(生成)
B.容器内气体的总压强保持不变
C.容器内气体的密度不变
D.vA:vB:vC=3:1:2
E.容器内气体C的物质的量分数保持不变
(2)①锌电池有望代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应方程式是2Zn+O2=2ZnO。则该电池的负极材料是__。
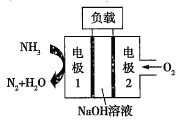
②瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池的示意图如图,该燃料电池工作时,电池的总反应方程式为__;负极的电极反应式为__。
【答案】3A(g)+B(g)![]() 2C(g) 0.1mol·L-1·s-1 40% BE 锌(或Zn) 4NH3+3O2=2N2+6H2O 2NH3-6e-+6OH-=N2+6H2O
2C(g) 0.1mol·L-1·s-1 40% BE 锌(或Zn) 4NH3+3O2=2N2+6H2O 2NH3-6e-+6OH-=N2+6H2O
【解析】
(1) 根据公式![]() 和表中数据可以求得
和表中数据可以求得![]() ①因为速率之比等于对应物质的化学计量数之比,所以
①因为速率之比等于对应物质的化学计量数之比,所以![]() ,
,![]() ,则
,则![]() ,
,![]() ,所以化学方程式为
,所以化学方程式为![]() ;故答案为:
;故答案为:![]() ;
;
②0~2s用物质B来表示的反应速率为![]() ,故答案为:0.1mol·L-1·s-1;
,故答案为:0.1mol·L-1·s-1;
③从反应开始到2s末,A物质的转化率![]() ,故答案为40%;
,故答案为40%;
④![]() (消耗)
(消耗)![]() (生成),正逆反应速率不相等,A项错误;该反应是反应前后气体体积不变的反应,容器内气体的总压强保持不变,说明各气体的物质的量不变,反应达到平衡状态,B项正确;容器内气体的密度始终不变,C项错误;只要反应发生,始终有
(生成),正逆反应速率不相等,A项错误;该反应是反应前后气体体积不变的反应,容器内气体的总压强保持不变,说明各气体的物质的量不变,反应达到平衡状态,B项正确;容器内气体的密度始终不变,C项错误;只要反应发生,始终有![]() ,D项错误;容器内气体C的物质的量分数保持不变,说明各组分的物质的量不变,反应达到平衡状态,E项正确,故答案选BE;
,D项错误;容器内气体C的物质的量分数保持不变,说明各组分的物质的量不变,反应达到平衡状态,E项正确,故答案选BE;
(2)①由反应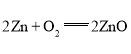 可知,锌失去电子,发生氧化反应,所以锌是负极,故答案为Zn(或锌);
可知,锌失去电子,发生氧化反应,所以锌是负极,故答案为Zn(或锌);
②在燃料电池的正极为氧气得到电子发生还原反应,碱性环境下的电极反应方程式为:O2+4e-+2H2O===4OH;负极上发生氨气失电子的氧化反应,电极反应式为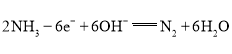 ,则电池的总反应相当于
,则电池的总反应相当于![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() :
: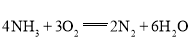 ;故答案为:4NH3+3O2=2N2
;故答案为:4NH3+3O2=2N2


科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式,回答下列问题:
①2H2(g)+O2(g)=2H2O(l) ΔH=﹣570kJ![]()
②2H2O(g)=2H2(g)+O2(g) ΔH=+483.6kJ![]()
③2C(s)+O2(g)=2CO(g) ΔH=﹣220.8kJ![]()
④C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ![]()
(1)上述反应中属于放热反应的是_____(填写序号);
(2)H2的燃烧热为_____;
(3)燃烧8g H2生成液态水,放出的热量为_____;
(4)H2O(l)=H2O(g)ΔH=______;
(5)CO的燃烧热的热化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个容积均为![]() 的恒容密闭容器中反应
的恒容密闭容器中反应![]() 达到平衡,下列说法正确的是
达到平衡,下列说法正确的是
容器 | 温度 | 物质的起始浓度 | 物质的平衡浓度 | ||
|
|
|
| ||
Ⅰ | 400 |
|
| 0 |
|
Ⅱ | 400 |
|
| 0 |
|
Ⅲ | 500 |
|
| 0 |
|
A. 该反应的正反应是吸热反应
B. 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的小
C. 达到平衡时,容器Ⅱ中![]() 小于容器Ⅲ中
小于容器Ⅲ中![]()
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2(g)+I2(g) ![]() 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B. 若压强不再随时间变化能说明反应A(?)+B(g)![]() 2C(?)已达平衡,则A、C不能同时是气体
2C(?)已达平衡,则A、C不能同时是气体
C. C(s)+H2O(g) ![]() H2(g)+CO,碳的质量不再改变不能说明反应已达平衡
H2(g)+CO,碳的质量不再改变不能说明反应已达平衡
D. 2NO2 ![]() N2O4(无色),体系颜色不再变化说明反应已达平衡,反应停止
N2O4(无色),体系颜色不再变化说明反应已达平衡,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
2Z(g)+W(s) ΔH<0,下列叙述正确的是 ( )
A. 平衡常数K值越大,X的转化率越大
B. 达到平衡时,反应速率v正(X)=2v逆(Z)
C. 达到平衡后降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D. 达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系不正确的是( )
A.沸点:戊烷>2-甲基丁烷>2,2—二甲基丙烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.同分异构体数目:C5H12>C5H10>C4H10>C4H8>C3H8
D.等物质的量燃烧耗O2量:C5H12>C5H10>C4H10>C4H8>C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法” 。完成下列填空:
(l)l0Be和9Be_______。
a.是同一种原子 b.具有相同的中子数
d.具有相同的化学性质 d.互为同位素
⑵写出A1与NaOH溶液反应的化学方程式:___________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是__________。
a.比较Mg (OH) 2与A1 (OH) 3的碱性强弱
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的单质的硬度和熔点
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的常见阴离子的半径由大到小的顺序:_______(用化学符号表示);其中一种离子与钾同周期相邻元素的离子所形成的化合物可用作干燥剂,用电子式表示该物质的形成过程__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com