
【题目】将一定质量Na2CO3和NaHCO3的均匀混合物分成等量的两份。将其中的一份直接加热至恒重,质量减轻了1.24 g;另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,消耗盐酸40.0 mL。试计算:
⑴原均匀混合物中NaHCO3的物质的量n(NaHCO3)=____ mol;
⑵盐酸的浓度c(HCl)=_____ mol·L-1。
【答案】0.08 4.00
【解析】
(1)加热时发生反应2NaHCO3![]() Na2CO3+H2O+CO2↑,固体减少的质量为水和二氧化碳的质量,且每分解2mol碳酸氢钠,即减少1molH2O和1molCO2,减少的总质量为18g+44g=62g,所以当固体减少1.24g时,n(NaHCO3)=
Na2CO3+H2O+CO2↑,固体减少的质量为水和二氧化碳的质量,且每分解2mol碳酸氢钠,即减少1molH2O和1molCO2,减少的总质量为18g+44g=62g,所以当固体减少1.24g时,n(NaHCO3)=![]() =0.04mol,因为原混合物是分成了两份,所以原混合中n(NaHCO3)=0.08mol;
=0.04mol,因为原混合物是分成了两份,所以原混合中n(NaHCO3)=0.08mol;
(2)另一份加入一定量某浓度的盐酸至恰好反应完全,收集到标准状况下2.24 L 气体,该气体应为CO2,且物质的量为0.1mol,根据元素守恒可知n(Na2CO3)+n(NaHCO3)=n(CO2)=0.1mol,所以每一份中碳酸钠的物质的量为:0.1mol-0.04mol=0.06mol,盐酸与混合物反应最终得到NaCl,根据钠离子守恒n(NaCl)=2n(Na2CO3)+n(NaHCO3)=0.06mol×2+0.04mol=0.16mol,根据氯离子守恒n(HCl)=n(NaCl)=0.16mol,则c(HCl)=0.16mol÷0.04L=4.00mol/L。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】高温下超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为﹣2价.如图所示为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是

A. 晶体中每个K+周围有8个O2﹣,每个O2﹣周围有8个K+
B. 晶体中与每个K+距离最近的K+有8个
C. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2﹣
D. 晶体中,0价氧与﹣2价氧的数目比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器里进行如下可逆反应:![]() 橙黄色液体
橙黄色液体![]() 气
气![]() 鲜红色液体
鲜红色液体![]() 。下列说法正确的是
。下列说法正确的是![]()
![]()
A. 达到平衡时,单位时间里消耗nmol![]() 的同时也生成n
的同时也生成n![]()
B. 增大压强,平衡常数将增大
C. 达到平衡时,若升高温度,氯气的百分含量减小
D. 加入氯气,平衡向正反应方向移动,氯气的转化率一定升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢、氮、氧、铁、铜等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)写出基态铜原子的价电子排布式__________________
(2)和铜在同一周期中,基态原子未成对电子数为2的元素共有______种。
(3)NH4HF2中HF2-的结构为F-H.......F-,则NH4HF2中含有的化学键有_________
(A)离子键 (B)共价键 (C)金属键 (D)氢键 (E)配位键
(4)写出与NH4+互为等电子体的一种分子的化学式________;
(5)CH3OH分子中C原子的杂化方式为_________,键角:H-C-H_______H-O-C。(填“<”、“>”、“=”)
(6)Cu与Cl形成某种化合物的晶胞如下图所示,Cu的配位数是________,该晶体的密度为ρg·cm-3,晶胞边长为acm,则阿伏加德罗常数为____________(用含ρ、a的代数式表示)。
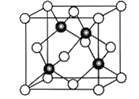
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研制出一种催化剂,能在室温下高效催化空气中HCHO的氧化,其反应如下:HCHO+O2![]() CO2+H2O。下列有关说法正确的是( )
CO2+H2O。下列有关说法正确的是( )
A. HCHO含有的官能团为羧基
B. CO2分子是由极性键形成的极性分子
C. HCHO分子中既含σ键又含π键
D. 每生成18 g H2O消耗22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯铁片和纯铜片按下图所示插入同浓度的稀硫酸中一段时间,下列叙述正确的是
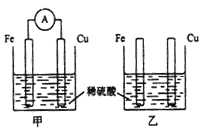
A. 甲装置中电能转化为化学能
B. 两个装置中铜片表面均有气泡产生
C. 甲装置中H+移向铜片发生还原反应
D. 甲中负极上发生的电极反应为Fe-3e-=Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向偏铝酸钠溶液中逐滴加入盐酸,溶液的pH值随着加入盐酸体积的变化曲线如图所示,则下列说法正确的是
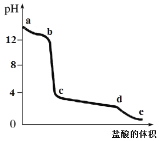
A.a~b段的主要离子方程式为A1O2+4H+=Al3++2H2O
B.向c点溶液中滴加氨水,发生的离子方程式为 A13++3OH=Al(OH)3↓
C.c~d段的主要离子方程式为Al(OH)3+3H+=A13++3H2O
D.向c点溶液中加入碳酸钠,发生的离子方程式为2A13++3CO32+3H2O=2Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备苯甲醇和苯甲酸的化学原理是2C6H5CHO+KOH![]() C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
C6H5CH2OH+C6H5COOK,C6H5COOK+HCl→C6H5COOH+KCl。已知苯甲醛易被空气氧化;苯甲醇的沸点为205.3 ℃,微溶于水,易溶于乙醚;苯甲酸的熔点为121.7 ℃,沸点为249 ℃,微溶于水,易溶于乙醚;乙醚的沸点为34.8 ℃,难溶于水。制备苯甲醇和苯甲酸的主要过程如下所示:
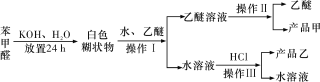
根据以上信息判断,下列说法错误的是
A. 操作Ⅰ是萃取分液
B. 操作Ⅱ蒸馏得到的产品甲是苯甲醇
C. 操作Ⅲ过滤得到的产品乙是苯甲酸钾
D. 乙醚溶液中所溶解的主要成分是苯甲醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com