
ЎѕМвДїЎїФЪПВБРёч±д»ЇЦРЈ¬EОЄОЮЙ«ОЮО¶µДТєМе(іЈОВПВ),FОЄµ»ЖЙ«·ЫД©Ј¬GОЄіЈјыµДОЮЙ«ЖшМе(·ґУ¦МхјюѕщТСКЎВФ)ЎЈ»ШґрПВБРОКМвЈє
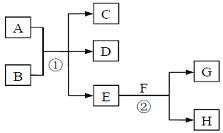
ЈЁ1Ј©ФЪ·ґУ¦ўЪЦРЈ¬ГїЙъіЙ2.24LЖшМеG(±кЧјЧґїц)К±Ј¬ёГ·ґУ¦ЧЄТЖµзЧУµДОпЦКµДБїКЗ____ЎЈ
ЈЁ2Ј©Иф·ґУ¦ўЩФЪИЬТєЦРЅшРРЈ¬AЎўCЎўDѕщє¬ВИФЄЛШЈ¬ЗТAЦРВИФЄЛШµД»ЇєПјЫЅйУЪCУлDЦ®јдЎЈФт·ґУ¦ўЩµДАлЧУ·ЅіМКЅКЗ__________ЎЈ
ЈЁ3Ј©Иф·ґУ¦ўЩФЪјУИИМхјюПВЅшРРЈ¬ЗТCЎўDКЗБЅЦЦѕщДЬК№іОЗеµДКЇ»ТЛ®±д»лЧЗµДОЮЙ«ЖшМеЈ¬Фт·ґУ¦ўЩµД»ЇС§·ЅіМКЅКЗ_____________ЎЈ
ЈЁ4Ј©Иф·ґУ¦ўЩФЪИЬТєЦРЅшРРЈ¬AКЗТ»ЦЦЗїјоЈ¬BКЗТ»ЦЦЛбКЅСОЈ¬DКЗТ»ЦЦЖшМеЈ¬ЗТBУцСОЛбУРЖшМеІъЙъЎЈФЪјУИИМхјюПВЈ¬µ±A№эБїК±Ј¬·ґУ¦ўЩµДАлЧУ·ЅіМКЅКЗ__________ЎЈ
Ўѕґр°ёЎї 0.2mol Cl2+2OH-=Cl-+ClO-+H2O C+2H2SO4ЈЁЕЁЈ©![]() CO2Ўь+2SO2Ўь+2H2O Ca2++2OH-+NH4++HCO3-
CO2Ўь+2SO2Ўь+2H2O Ca2++2OH-+NH4++HCO3-![]() CaCO3Ўэ+NH3Ўь+2H2O[KOHЎўBa(OH)2¶јїЙТФ]
CaCO3Ўэ+NH3Ўь+2H2O[KOHЎўBa(OH)2¶јїЙТФ]
ЎѕЅвОцЎїКФМв·ЦОцЈє±ѕМвїјІйОЮ»ъНЖ¶ПЎЈіЈОВПВEОЄОЮЙ«ОЮО¶µДТєМеЈ¬EОЄH2OЈ»FОЄµ»ЖЙ«·ЫД©Ј¬FДЬУлH2O·ґУ¦Ј¬FОЄNa2O2Ј¬Na2O2УлH2O·ґУ¦µД»ЇС§·ЅіМКЅОЄ2Na2O2+2H2O=4NaOH+O2ЎьЈ»GОЄіЈјыµДОЮЙ«ЖшМеЈ¬GОЄO2Ј¬HОЄNaOHЎЈ
ЈЁ1Ј©·ґУ¦ўЪОЄ2Na2O2+2H2O=4NaOH+O2ЎьЈ¬УГЛ«ПЯЗЕ±кіцµзЧУЧЄТЖ·ЅПтєНКэДїОЄЈє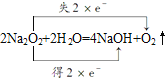 Ј¬ЙъіЙ1molO2ЧЄТЖ2molµзЧУЈ¬nЈЁO2Ј©=
Ј¬ЙъіЙ1molO2ЧЄТЖ2molµзЧУЈ¬nЈЁO2Ј©=![]() =0.1molЈ¬ФтЧЄТЖµзЧУОпЦКµДБїОЄ0.2molЎЈ
=0.1molЈ¬ФтЧЄТЖµзЧУОпЦКµДБїОЄ0.2molЎЈ
ЈЁ2Ј©Иф·ґУ¦ўЩФЪИЬТєЦРЅшРРЈ¬AЎўCЎўDѕщє¬ВИФЄЛШЈ¬ЗТAЦРВИФЄЛШµД»ЇєПјЫЅйУЪCУлDЦ®јдЈ¬EОЄH2OЈ¬·ґУ¦ўЩОЄCl2УлOH-µДЖз»Ї·ґУ¦Ј¬·ґУ¦µДАлЧУ·ЅіМКЅОЄCl2+2OH-=Cl-+ClO-+H2OЎЈ
ЈЁ3Ј©Иф·ґУ¦ўЩФЪјУИИМхјюПВЅшРРЈ¬ЗТCЎўDКЗБЅЦЦѕщДЬК№іОЗеµДКЇ»ТЛ®±д»лЧЗµДОЮЙ«ЖшМеЈ¬ФтCЎўDОЄCO2ЎўSO2Ј¬EОЄH2OЈ¬Фт·ґУ¦ўЩОЄCУлЕЁБтЛбµД·ґУ¦Ј¬·ґУ¦ўЩµД»ЇС§·ЅіМКЅОЄC+2H2SO4ЈЁЕЁЈ©![]() CO2Ўь+2SO2Ўь+2H2OЎЈ
CO2Ўь+2SO2Ўь+2H2OЎЈ
ЈЁ4Ј©Иф·ґУ¦ўЩФЪИЬТєЦРЅшРРЈ¬AКЗТ»ЦЦЗїјоЈ¬BКЗТ»ЦЦЛбКЅСОЈ¬DКЗТ»ЦЦЖшМеЈ¬ЗїјоУлЛбКЅСО·ґУ¦ІъЙъЖшМеЈ¬ФтDОЄNH3Ј¬AїЙДЬОЄKOHЎўCaЈЁOHЈ©2ЎўBaЈЁOHЈ©2µИЈ¬BОЄп§СОЈ»BУцСОЛбУРЖшМеІъЙъЈ¬BїЙДЬОЄМјЛбЗвСОЎўСЗБтЛбЗвСОµИЈ»BїЙДЬОЄNH4HCO3ЎўNH4HSO3µИЎЈИфAОЄKOHЈ¬јУИИМхјюПВ·ґУ¦ўЩµДАлЧУ·ЅіМКЅїЙДЬОЄЈє2OH-+NH4++HCO3-![]() NH3Ўь+CO32-+2H2OЎў2OH-+NH4++HSO3-
NH3Ўь+CO32-+2H2OЎў2OH-+NH4++HSO3-![]() NH3Ўь+SO32-+2H2OЈ»ИфAОЄCaЈЁOHЈ©2Ј¬јУИИМхјюПВ·ґУ¦ўЩµДАлЧУ·ЅіМКЅїЙДЬОЄЈєCa2++2OH-+NH4++HCO3-
NH3Ўь+SO32-+2H2OЈ»ИфAОЄCaЈЁOHЈ©2Ј¬јУИИМхјюПВ·ґУ¦ўЩµДАлЧУ·ЅіМКЅїЙДЬОЄЈєCa2++2OH-+NH4++HCO3-![]() CaCO3Ўэ+NH3Ўь+2H2OЎўCa2++2OH-+NH4++HSO3-
CaCO3Ўэ+NH3Ўь+2H2OЎўCa2++2OH-+NH4++HSO3-![]() CaSO3Ўэ+NH3Ўь+2H2OЈ»ИфAОЄBaЈЁOHЈ©2Ј¬јУИИМхјюПВ·ґУ¦ўЩµДАлЧУ·ЅіМКЅїЙДЬОЄЈєBa2++2OH-+NH4++HCO3-
CaSO3Ўэ+NH3Ўь+2H2OЈ»ИфAОЄBaЈЁOHЈ©2Ј¬јУИИМхјюПВ·ґУ¦ўЩµДАлЧУ·ЅіМКЅїЙДЬОЄЈєBa2++2OH-+NH4++HCO3-![]() BaCO3Ўэ+NH3Ўь+2H2OЎўBa2++2OH-+NH4++HSO3-
BaCO3Ўэ+NH3Ўь+2H2OЎўBa2++2OH-+NH4++HSO3-![]() BaSO3Ўэ+NH3Ўь+2H2OЎЈ
BaSO3Ўэ+NH3Ўь+2H2OЎЈ


 МфХЅ100µҐФЄјмІвКФѕнПµБРґр°ё
МфХЅ100µҐФЄјмІвКФѕнПµБРґр°ё ГыМвЅрѕнПµБРґр°ё
ГыМвЅрѕнПµБРґр°ё
| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї¶ФУЪїЙДж·ґУ¦AЈЁgЈ©+2BЈЁgЈ©2CЈЁgЈ©ЎчHЈѕ0Ј¬ПВБРНјПуЦРХэИ·µДКЗЈЁ Ј©
A.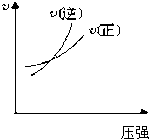
B.
C.
D.
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїУР»ъОпMКЗ±ЅµДН¬ПµОпЈ¬ЖдЅб№№ОЄ ![]() Ј¬ФтMїЙДЬµДЅб№№јтКЅ№ІУРЈЁ Ј©
Ј¬ФтMїЙДЬµДЅб№№јтКЅ№ІУРЈЁ Ј©
A.6ЦЦ
B.12ЦЦ
C.24ЦЦ
D.32ЦЦ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТ»°ь°ЧЙ«·ЫД©Ј¬УЙјёЦЦіЈјыµДСО»мєПЧйіЙЈ¬ЖдЦРїЙДЬє¬УРNa+ЎўK+ЎўAl3+ЎўCO32©ЃЎўHCO3©ЃЎўSO42©ЃЎўSO32©ЃЎўNO2©ЃЦРµДИфёЙЦЦАлЧУЈ®ДіН¬С§¶ФёГИЬТєЅшРРИзПВКµСйЈє 
ТФПВЛµ·ЁХэИ·µДКЗЈЁ Ј©
A.°ЧЙ«іБµнјЧКЗAlЈЁOHЈ©3 Ј¬ ЖшМејЧКЗCO2 Ј¬ ЛщТФ»мєПОпТ»¶Ёє¬Al3+єНHCO3©Ѓ
B.ЖшМеТТТ»¶ЁКЗNOєНNO2µД»мєПЖшМе
C.°ЧЙ«іБµнТТКЗBaSO4 Ј¬ ЛщТФФ»мєПОпТ»¶Ёє¬УРSO42©Ѓ
D.СжЙ«·ґУ¦ОЄ»ЖЙ«»рСжЈ¬І»ДЬИ·¶ЁФ»мєПОпЦРІ»є¬K+
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРАлЧУ·ЅіМКЅХэИ·µДКЗЈЁ Ј©
A. ДЖУлЛ®·ґУ¦ЈєNa+2H2O= Na+ +2OH- + H2Ўь
B. №иЛбДЖИЬТєУлґЧЛбИЬТє»мєПЈєSiO32- + 2H+= H2SiO3Ўэ
C. 0.01mol/L NH4Al(SO4)2 ИЬТєУл0.02mol/L Ba(OH)2 ИЬТєµИМе»э»мєП:
NH4+ +Al3 + +2SO42- +2Ba2+ +4OH- = 2BaSO4 Ўэ+AlЈЁOHЈ©3 Ўэ+ NH3Ў¤H2O
D. ЕЁПхЛбЦРјУИл№эБїМъ·ЫІўјУИИЈєFe+3NO3-+6H+ = Fe3+ +3NO2Ўь+3H2O
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї·ЦЦ¦ЛбїЙУГУЪЙъ»ЇСРѕїЈ¬ЖдЅб№№јтКЅИзНјЈ®ПВБР№ШУЪ·ЦЦ¦ЛбµДРрКцХэИ·µДКЗЈЁ Ј© 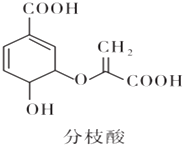
A.Жд·ЦЧУКЅОЄC10H8O6
B.їЙУлТТґјЎўТТЛб·ґУ¦Ј¬ЗТ·ґУ¦АаРНПаН¬
C.1 mol·ЦЦ¦ЛбФЪТ»¶ЁМхјюПВЧо¶аїЙУл3 mol NaOH·ўЙъ·ґУ¦
D.їЙК№деµДЛДВИ»ЇМјИЬТєЎўЛбРФёЯГМЛбјШИЬТєНКЙ«Ј¬ЗТФАнПаН¬
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїДі100mL»мєПТєЦРЈ¬HNO3єНH2SO4µДОпЦКµДБїЕЁ¶И·Ц±рОЄ0.4mol/LєН0.1mol/LЎЈПтёГ»мєПТєЦРјУИл1.92gН·ЫЈ¬јУИИК№·ґУ¦·ўЙъНкИ«ЎЈПВБРЛµ·ЁХэИ·µДКЗ(єцВФ·ґУ¦З°єуИЬТєМе»э±д»Ї)( )
AЈ®ЛщµГИЬТєЦРc(Cu2+)ЈЅ0.225mol/L BЈ®ЛщµГИЬТєЦРc(Cu2+)ЈЅ0.03mol/L
CЈ®ЛщµГЖшМеФЪ±кЧјЧґїцПВµДМе»эОЄ0.448L DЈ®·ґУ¦ЦРЧЄТЖ0.06molµДµзЧУ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎї№ШУЪАлЧУ·ЅіМКЅCu2Ј«Ј«2OHЈ=Cu(OH)2ЎэµДЛµ·ЁХэИ·µДКЗЈЁ Ј©
A. їЙ±нКѕЛщУРНСОєНЗїјоµД·ґУ¦
B. їЙ±нКѕДіТ»ёцѕЯМеµД·ґУ¦Ј¬ТІїЙТФ±нКѕТ»Аа·ґУ¦
C. АлЧУ·ЅіМКЅЦРµДOHЈїЙґъ±нИхјо»тЗїјо
D. ёГ·ґУ¦їЙїґµЅCu(OH)2°ЧЙ«іБµн
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЪИЬТєЦРЈ¬ДЬґуБї№ІґжµДАлЧУЧйКЗ
A.Na+ЎўMg2+ЎўSO42ЎўOHB.Na+ЎўBa2+ЎўClЎўSO42
C.Cu2+ЎўCa2+ЎўClЎўNO3D.Ag+ЎўK+ЎўNO3ЎўCl
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com