
����Ŀ����֪NH3��CuO����ʱ��Ӧ������Cu��N2��ijʵ��С����������ͼ��ʾʵ��װ�òⶨij5 g CuO(��Cu)��Ʒ�Ĵ���
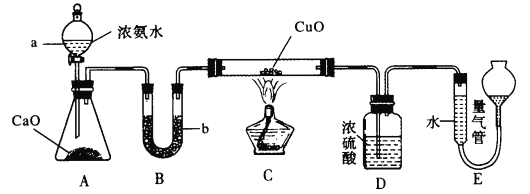
��ش���������:
(1)��ƿ�е���ʯ�ҿ����Լ�____���棬����b����ʢ�Լ�Ϊ______(������)��
(2)װ��C��Ӳ�ʲ������з�����Ӧ�Ļ�ѧ����ʽΪ___________
(3)װ��D������Ϊ________
(4)��ȡװ��E���������е��������ʱӦע�������Ϊ_______
��װ��E��������������ڱ�״����ʱΪ336 mL������Ʒ��CuO�ĺ���Ϊ___%��������ʱ���Һ������ұ�Һ�棬����CuO������____(����ƫ������ƫ����������Ӱ����)��
���𰸡�NaOH������ʯ�� ��ʯ�� 2NH3ʮ3CuO![]() 3Cu+N2+3H2O ���չ�����NH3�����ɵ�ˮ���� �ָ������¡�������������Һ����ƽ��ƽ�Ӷ��� 72 ƫ��
3Cu+N2+3H2O ���չ�����NH3�����ɵ�ˮ���� �ָ������¡�������������Һ����ƽ��ƽ�Ӷ��� 72 ƫ��
��������
Ũ��ˮ�ε���ʯ���ϲ�����������������ʯ�Ҹ�������װ��C������ͭ���������·�Ӧ��������������Ũ����(��ȥ�����İ����Ͳ�����ˮ)������������ڲ�����������ݴ˷������
(1)��ƿ�е���ʯ�ҵ��������������ܽ���ȣ��Ҳ�����������������Ũ��ˮ�ֽ��������������ͬ�����õ����������ƹ������ʯ�ң�����B�е�ҩƷ�Ǹ��ﰱ���ļ�ʯ�ң��ʴ�Ϊ���������ƹ������ʯ�ң���ʯ�ң�
(2)װ��C�з���NH3��CuO����ʱ��Ӧ������Cu��N2����ӦΪ��2NH3ʮ3CuO![]() 3Cu+N2+3H2O���ʴ�Ϊ��2NH3ʮ3CuO
3Cu+N2+3H2O���ʴ�Ϊ��2NH3ʮ3CuO![]() 3Cu+N2+3H2O��
3Cu+N2+3H2O��
(3)װ��D��ΪŨ���ᣬ��������δ��Ӧ��İ����Ͳ�����ˮ��������ֹ�Ե����������������Ӱ�죬�ʴ�Ϊ�����չ�����NH3�����ɵ�ˮ������
(4)��ȡװ��E���������е��������ʱӦ��װ����ȴ�����º����������������Һ���ƽ���ٶ���������ʱҪƽʱ�̶ȣ���װ��E��������������ڱ�״����ʱΪ336 mL�������������Ϊ336mL��n(N2)=0.015mol����������Ӧ�ɵã�n(CuO)=0.045mol����Ʒ��CuO�ĺ���Ϊ�ʴ�Ϊ��![]() ��������ʱ���Һ������ұ�Һ�棬������������ƫ������������ͭ����ƫ�ߣ�����ƫ�ߣ��ʴ�Ϊ���ָ������¡�������������Һ����ƽ��ƽ�Ӷ�����72��ƫ�ߣ�
��������ʱ���Һ������ұ�Һ�棬������������ƫ������������ͭ����ƫ�ߣ�����ƫ�ߣ��ʴ�Ϊ���ָ������¡�������������Һ����ƽ��ƽ�Ӷ�����72��ƫ�ߣ�


 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ���Ũ�Ⱦ�Ϊ0.1molL-1�Ģ�NH4Cl��Һ����NaCl��Һ����HCl��Һ��20mL������˵��������ǣ� ��
A.������Һ��c(Cl-)�Ĺ�ϵ�Ǣ�=��=��
B.����������Һϡ����ͬ�ı�����pH�仯��С���Ǣ�
C.������Һ����ˮ�������c(H+)�Ĺ�ϵ�Ǣ�<��<��
D.����������Һ�зֱ����20mL0.1molL-1��NaOH��Һ��pH��С���Ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Al2��SO4��3��AlCl3�Ļ����Һ����μ���1mol/L Ba��OH��2��Һ������������Ba��OH��2��Һ����������ó��������ʵ����Ĺ�ϵ��ͼ������˵������ȷ���ǣ� ��
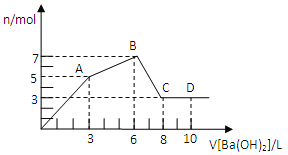
A. ͼ��C����Ԫ�ش�����ʽ��AlO2��
B. ��D����Һ��ͨ��C02���壬����������ɫ����
C. ԭ���Һ��c[Al2��SO4��3]��c��AlCl3��=1��2
D. OA�η�Ӧ�����ӷ���ʽΪ��3Ba2++2Al3++8OH-+3SO4=BaSO4��+2AlO2-+4H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ�о�С��̽�����������������ѹǿ���¶ȣ��Ի�ѧ��ӦmA(g)+nB(g)![]() qC(g)�����ʺ�ƽ���Ӱ��ͼ����ͼ��ʾ�������ж���ȷ����
qC(g)�����ʺ�ƽ���Ӱ��ͼ����ͼ��ʾ�������ж���ȷ����
A.��ͼ��֪��T1<T2,�÷�Ӧ������ӦΪ���ȷ�Ӧ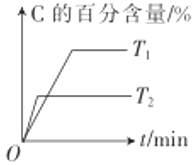
B.��ͼ��֪���÷�Ӧm+n<q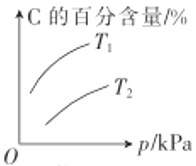
C.ͼ�У���3�ķ�Ӧ���ʣ�v��>v��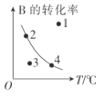
D.ͼ�У���m+n=q,������aһ��ʹ���˴���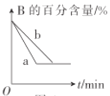
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��T��Cʱ����6mol A(g)��2molB(g)����2L�ĺ����ܱ������з�����Ӧ��3A(g)+B(g)mC(g)+2D(s)�����2s��C(g)��ƽ����Ӧ����Ϊ0.3 mol��L-1��s-1����2sĩD(g)�����ʵ���Ϊ1.2 mol��
��ش��������⣺
(1)m=_____
(2)2s��������A��ʾ��ƽ����Ӧ����Ϊ______��
(3)2sĩʱ����B��ת����Ϊ_____
(4)��2sĩ��ʼ��C��Ũ�ȱ�Ϊ1.2 mol��L-1ʱ���õ�ʱ��____2s(��"��������С��������������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���������Mg(OH)2������ˮ��Һ�дﵽƽ��ʱ��Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),ҪʹMg(OH)2�������ӣ�c(OH-)���ӣ��ɲ�ȡ�Ĵ�ʩ��
Mg2+(aq)+2OH-(aq),ҪʹMg(OH)2�������ӣ�c(OH-)���ӣ��ɲ�ȡ�Ĵ�ʩ��
A.��������ˮB.ͨ������HCl����
C.������NaOH����D.������MgSO4����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڼס��ҡ����������º��ݵ��ܱ������У��ֱ������������̿��һ������ NO�����з�ӦC(s)+2NO(g) ![]() N2(g)+CO2(g)����ø������� c(NO)�淴Ӧʱ�� t �ı仯������±���ʾ������˵����ȷ����( )
N2(g)+CO2(g)����ø������� c(NO)�淴Ӧʱ�� t �ı仯������±���ʾ������˵����ȷ����( )
�������¶ȣ� | 0min | 40min | 80min | 120min | 160min | |
�ף�400�棩 | c(NO) | 2.00 mol/ L | 1.50 mol/ L | 1.10 mol/ L | 0.80 mol/ L | 0.80 mol/ L |
�ң�400�棩 | c(NO) | 1.00 mol/ L | 0.80 mol/ L | 0.65 mol/ L | 0.53 mol/ L | 0.45 mol/ L |
����T�棩 | c(NO) | 2.00 mol/ L | 1.40 mol/ L | 1.10 mol/ L | 1.10 mol/ L | 1.10 mol/ L |
A.�ﵽƽ��״̬ʱ��2v��(NO)= v��(N2)
B.����̿���������ٸı䲻��˵����Ӧ�Ѵ�ƽ��״̬
C.�������У��ӷ�Ӧ��ʼ������ƽ��ʱ��ƽ����Ӧ����Ϊv(NO) >0.01125 mol��L-1��min-1
D.�ɱ������ݿ�֪��T��400��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԷϾ�п�̵�س���������ѡ���ĺ��̷���(MnO2��MnOOH��MnO������Fe��Pb�ȣ�Ϊԭ���Ʊ��ߴ�MnCl2��xH2O��ʵ���̵��������á��乤���������£�
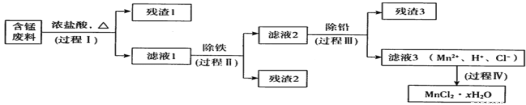
����a:Mn�Ľ������ǿ��Fe��Mn2+�����������±Ƚ��ȶ���pH����5.5ʱ�ױ�O2������
����b�������������������pH
Mn��OH��2 | Pb��OH��2 | Fe��OH��3 | |
��ʼ����ʱ | 8.1 | 6.5 | 1.9 |
��ȫ����ʱ | 10.1 | 8.5 | 3.2 |
ע���������ӵ���ʼŨ��Ϊ0.1 mol��L-l
(1)����I��Ŀ���ǽ����̡���������Һ1�к��е�������ΪMn2+��Fe3+��Pb2+��H+��
��MnO2��Ũ���ᷴӦ�����ӷ���ʽ��____________��
�ڼ�����Һ1��ֻ��Fe3+����Fe2+�IJ����������ǣ��ֱ�ȡ����������Һ1���Թ��У�һ��__________����һ�� ________________��
��Fe3+��Fe2+ת�����ɣ����ܷ����ķ�Ӧ�У�
a. 2Fe2++Cl2= 2Fe3++2Cl- b.4Fe2++O2+4H+=4Fe3++2H2O
c������ д��c�����ӷ���ʽ��____________________��
(2)���̢��Ŀ���dz��������������ַ�����
i����ˮ��������Һ1��ϡ�ͣ��ټ�����10%�İ�ˮ�����ˡ�
ii�����շ�������ҺlŨ���õ��Ĺ�����290�決�գ���ȴ��ȡ�������ˮ�ܽ⡢���ˣ���Һ�ټ������ữ������pH��
��֪�������з�������Ҫ��ӦΪ2FeCl3+3O2![]() 2Fe2O3+3Cl2������ʱMnCl2��PbCl2�������仯��
2Fe2O3+3Cl2������ʱMnCl2��PbCl2�������仯��
�ٰ�ˮ������ʱ����ҺpHӦ������__________֮�䡣
�����ַ����Ƚϣ���ˮ��������ȱ����____________��
(3)���̢��Ŀ���dz�Ǧ��������Լ���____________��
(4)���̢����ù����е�x�IJⶨ���£�ȡm1g��Ʒ�����ڵ�����Χ�м�����ʧȥȫ���ᾧˮʱ��������������m2g����x=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ԭ�ӻ�ԭ���ţ��밴Ҫ��ѡ��������д������Ҫ����л���Ľṹ��ʽ����CH3����OH����CHO����COOH����Br����H����CH2CH3��![]()
��l�����ӽṹΪ����������ǣ�___��
��2����ʹFeCl3��Һ����ɫ���ǣ�___��
��3����NaOH�Ҵ���Һ���ܷ�����ȥ��Ӧ���ǣ�____��
��4��1mol���л�����������������Һ��Ӧ����4molAg���ɵ��ǣ�___��
��5����Է���������60���ܺ�NaHCO3��Ӧ�ų�CO2���ǣ�___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com