
【题目】以废旧锌锰电池初步处理分选出的含锰废料(MnO2、MnOOH、MnO及少量Fe、Pb等)为原料制备高纯MnCl2·xH2O,实现锰的再生利用。其工作流程如下:
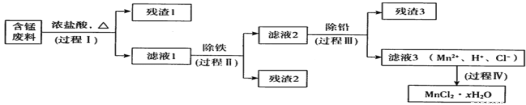
资料a:Mn的金属活动性强于Fe;Mn2+在酸性条件下比较稳定,pH高于5.5时易被O2氧化。
资料b:生成氢氧化物沉淀的pH
Mn(OH)2 | Pb(OH)2 | Fe(OH)3 | |
开始沉淀时 | 8.1 | 6.5 | 1.9 |
完全沉淀时 | 10.1 | 8.5 | 3.2 |
注:金属离子的起始浓度为0.1 mol·L-l
(1)过程I的目的是浸出锰。经检验滤液1中含有的阳离子为Mn2+、Fe3+、Pb2+和H+。
①MnO2与浓盐酸反应的离子方程式是____________。
②检验滤液1中只含Fe3+不含Fe2+的操作和现象是:分别取两份少量滤液1于试管中,一份__________;另一份 ________________。
③Fe3+由Fe2+转化而成,可能发生的反应有:
a. 2Fe2++Cl2= 2Fe3++2Cl- b.4Fe2++O2+4H+=4Fe3++2H2O
c.…… 写出c的离子方程式:____________________。
(2)过程Ⅱ的目的是除铁。有如下两种方法:
i.氨水法:将滤液1先稀释,再加适量10%的氨水,过滤。
ii.焙烧法:将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物加水溶解、过滤,滤液再加盐酸酸化至合适pH。
已知:焙烧中发生的主要反应为2FeCl3+3O2![]() 2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
2Fe2O3+3Cl2,焙烧时MnCl2和PbCl2不发生变化。
①氨水法除铁时,溶液pH应控制在__________之间。
②两种方法比较,氨水法除铁的缺点是____________。
(3)过程Ⅲ的目的是除铅。加入的试剂是____________。
(4)过程Ⅳ所得固体中的x的测定如下:取m1g样品,置于氮气氛围中加热至失去全部结晶水时,固体质量减轻m2g。则x=________。
【答案】MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O 加铁氰化钾,无现象 滴加KSCN溶液,溶液变红 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O 3.2~5.5(或3.2≤pH≤5.5或3.2≤pH<5.5) 引入杂质NH4+ 锰
Mn2++Cl2↑+2H2O 加铁氰化钾,无现象 滴加KSCN溶液,溶液变红 MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O 3.2~5.5(或3.2≤pH≤5.5或3.2≤pH<5.5) 引入杂质NH4+ 锰 ![]()
【解析】
(1) ①浓盐酸与二氧化锰反应产生氯气、氯化锰和水;
②Fe3+使KSCN溶液显红色,Fe2+可使铁氰化钾显蓝色;
③Fe3+由Fe2+转化而成,可能由氯气、氧气氧化,也可能由二氧化锰氧化;
(2) ①调节pH除去铁离子,铁离子沉淀完全,铅离子、锰离子不能沉淀;
②焙烧法除铁,将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,即可,而氨水法除铁溶液中会引入铵根离子;
(3)过程Ⅲ的目的是除铅,加入锰,不引入杂质;
(4)根据1:x=n(MnCl2):n(H2O)计算。
(1) ①浓盐酸与二氧化锰反应产生氯气、氯化锰和水,离子方程式为:MnO2+4H++2Cl![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
②Fe3+使KSCN溶液显红色,Fe2+可使铁氰化钾显蓝色,则取少量滤液1于试管中,滴入铁氰化钾溶液,无明显变化;另取少量滤液1于试管中,再滴加KSCN溶液,溶液变红;
③Fe3+由Fe2+转化而成,可能由氯气、氧气氧化,也可能由二氧化锰氧化,反应为:MnO2+4H++2Fe2+=Mn2++2Fe3++2H2O;
(2) ①调节pH除去铁离子,pH大于3.2时,铁离子沉淀完全,铅离子、锰离子不能沉淀,小于5.5时锰离子不易氧化,故pH应小于5.5;
②焙烧法除铁,将滤液l浓缩得到的固体于290℃焙烧,冷却,取焙烧物,加水溶解,过滤,即可,而氨水法除铁溶液中会引入铵根离子;
(3)过程Ⅲ的目的是除铅,用活泼金属置换不活泼金属,加入锰,将铅离子置换与溶液分离,自身生成锰离子,不引入杂质;
(4)m1gMnCl2xH2O置于氮气氛围中加热至失去全部结晶水时,生成MnCl2,减少的质量为结晶水的质量,为m(H2O)=m2g,则m(MnCl2)= (m1- m2)g,则1:x=n(MnCl2):n(H2O)=![]() :
:![]() ,解得x=
,解得x=![]() 。
。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】A~G各物质间的关系如图,其中B、D为气态单质。

请回答下列问题。
(1)物质C和E的名称分别为_______、_______;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为___________________;若只能在加热情况下进行,则反应物A应为_______;
(3)MnO2在反应①和反应②中的作用分别是_______、_______;
(4)新配制的F溶液应加入_______以防止其转化为G。检验G溶液中阳离子的常用试剂是_______,实验现象为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
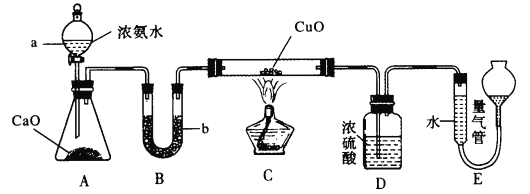
【题目】已知NH3和CuO高温时反应能生成Cu和N2,某实验小组欲利用如图所示实验装置测定某5 g CuO(含Cu)样品的纯度
请回答下列问题:
(1)锥形瓶中的生石灰可用试剂____代替,仪器b中所盛试剂为______(填名称)。
(2)装置C中硬质玻璃管中发生反应的化学方程式为___________
(3)装置D的作用为________
(4)读取装置E中量气管中的气体体积时应注意的事项为_______
若装置E中所得气体体积在标准状况下时为336 mL,则样品中CuO的含量为___%。若读数时左边液面高于右边液面,则测得CuO含量将____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
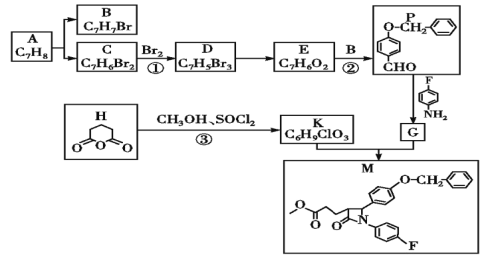
【题目】依折麦布(Ezetimibe)是一种高效的的胆固醇吸收抑制剂,合成它的一种重要中间体M的结构如图所示。某兴趣小组以甲苯和戊二酸酐为原料,设计了以下合成路线,部分条件和产物已略去。
已知:Ⅰ.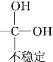
![]()
![]()
Ⅱ.![]() +RNH2
+RNH2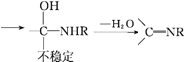
Ⅲ.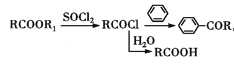 (R1为H或烃基)
(R1为H或烃基)
请回答:
(1)物质A的结构简式为______。
(2)下列说法正确的是______。
A.由甲苯制B需用Fe作催化剂
B.物质H水解后产物的最简单同系物为乙二酸
C.反应①②③均为取代反应
D.1mol物质C最多能与2molNaOH反应
(3)写出反应②的化学方程式:_____。
(4)写出同时符合下列条件的比![]() 多2个碳的同系物N的所有同分异构体的结构简式:______。
多2个碳的同系物N的所有同分异构体的结构简式:______。
①属芳香族化合物②能与酸反应③1H—NMR谱中出现3个峰
(5)设计以苯和乙烯为原料制备另一种医药中间体二苯甲酮(![]() )的合成路线:_____(用流程图表示,无机试剂任选)。
)的合成路线:_____(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
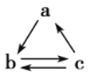
A.单质![]() 氧化物
氧化物![]() 酸或碱
酸或碱![]() 盐,硅单质可以按上述关系进行转化
盐,硅单质可以按上述关系进行转化
B.若a、b、c分别为Si、SiO2、H2SiO3,则可以通过一步反应实现如图所示的转化关系
C.二氧化碳和二氧化硅都可溶解在NaOH溶液中
D.青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式可表示为Al2O3·SiO2·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α—松油醇是生产香精的重要原料,合成路线如图所示:
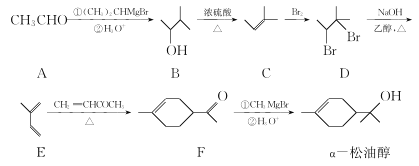
(1)α—松油醇中所含官能团的名称为______________。
(2)C→D的反应类型为______________ 。
(3)E→F的反应中有副产物X(与F互为同分异构体)生成,写出X的结构简式:______________。
(4)α—松油醇的一种同分异构体同时满足下列条件.写出该同分异构体的结构简式:______________。
①分子中所有化学键均饱和;
②分子中不同化学环境的氢原子数目比为1:4:4。
(5)已知:RBr![]() RMgBr(R表示经基)。写出以溴乙烷和2—溴丙为烷原料制备
RMgBr(R表示经基)。写出以溴乙烷和2—溴丙为烷原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物无论以何种比例混合,只要总的物质的量一定,完全燃烧时消耗氧气的量是定值的是
①CH2O、C2H4O2、C6H1206
②H2、CO、CH3OH
③CH2=CH2、C2H5OH、HOCH2CH2COOH
④C6H6、 C5H10、C7H6O2
A.③④B.①②C.①④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )
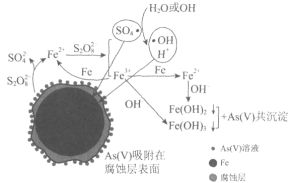
A.1mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56gFe参加反应,共有NA个S2O82-被还原
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为2.7×10-18mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com