
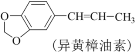
【题目】实验室利用反应: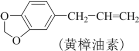
![]()
![]()
![]() 合成洋茉莉醛的流程如图所示。下列说法错误的是( )
合成洋茉莉醛的流程如图所示。下列说法错误的是( )
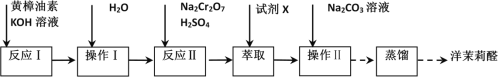
A.水洗的目的是除去KOH
B.试剂X应选用有机溶剂
C.黄樟油素和异黄樟油素互为同分异构体
D.进行蒸馏操作时可选用球形冷凝管
 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】全球碳计划组织(GCP,The Global Carbon Project)报告称,2018年全球碳排放量约371亿吨,达到历史新高。
(1)中科院设计了一种新型的多功能复合催化剂,实现了CO2直接加氢制取高辛烷值汽油,其过程如图1所示。

①已知:CO2(g)+H2(g)=CO(g)+H2O(g) △H= + 41 kJ·mol-1
2CO2(g)+6H2(g)=4H2O(g)+CH2=CH2(g) △H= -128 kJ·mol-1
则上述过程中CO和H2转化为CH2=CH2的热化学方程式是_________。
②下列有关CO2转化为汽油的说法,正确的是___________________(填标号)。
A. 该过程中,CO2转化为汽油的转化率高达78%
B. 中间产物Fe5C2的生成是实现CO2转化为汽油的关键
C. 在Na-Fe3O4上发生的反应为CO2+H2=CO+H2O
D. 催化剂HZSM-5可以提高汽油中芳香烃的平衡产率
③若在一容器中充入一定量的CO2和H2,加入催化剂恰好完全反应,且产物只生成C5以上的烷烃类物质和水。则起始时CO2和H2的物质的量之比不低于_________。
(2)研究表明,CO2和H2在一定条件下可以合成甲醇。反应方程式为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
CH3OH(g)+H2O(g) △H<0。一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0molH2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化关系如图2所示。
①该反应自发进行的条件是__________(填“高温”“低温”或“任意温度”)
②催化效果最佳的催化剂是__________(填“A”“B”或“C”);b点时,![]() ________
________![]() (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③若容器容积保持不变,则不能说明该反应达到化学平衡状态的是________。
a.c(CO2)与c(H2)的比值保持不变
b.v(CO2)正=v(H2O)逆
c.体系的压强不再发生变化
d.混合气体的密度不变
e.有lmolCO2生成的同时有断开3mol的H-H键
f.气体的平均相对分子质量不变
④已知容器内的起始压强为100 kPa,若图2中c点已达到平衡状态,则该温度下反应的平衡常数Kp =____________________(只列出计算式,不要求化简,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 8 种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是_____,⑧的元素符号是_____。②在元素周期表中的位置是(周期、族)_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____;名称是________; 碱性最强的化合物的电子式是:_________; 属_____化合物(填“离子”或“共价”)。
(3)①的最简单氢化物的电子式为_____, ⑦的最简单氢化物的电子式为_____,结构式为_____。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其核电荷数,请你根据下面的提示做出自己的判断。
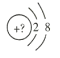
(1)若该微粒是电中性微粒,这种微粒的元素符号是___。
(2)若该微粒的还原性很弱,失去1个电子后变为原子,该原子的单质氧化性很强,该单质与水反应的化学方程式为___。
(3)若该微粒的氧化性很弱,得到1个电子后变为原子,该原子的单质还原性很强,该单质在氧气中燃烧所得产物的化学式为___。
(4)若该微粒的还原性很弱,失去2个电子后变成原子,其氢化物的结构式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的离子结构示意图为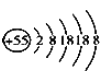 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:![]() ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 | _______ |
② | 降低温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 使用V2O5作催化剂 | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;
Ⅱ.![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
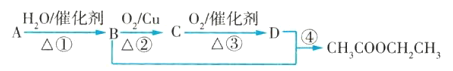
试回答下列问题:
(1)写出A的结构式___________________________________。
(2)B、D分子中的官能团名称分别是:_________________、________________。
(3)写出下列反应的反应类型:①_________________,②________________,④__________。
(4)写出下列反应的化学方程式:
①_______________________________________;
②_______________________________________;
④_______________________________________。
(5)设计实验区别B和D:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库。

(1)海水中制得的氯化钠可用于生产烧碱及氯气,装置如图所示,下列说法正确的是____(填字母)。

A.阴极反应式是:Na++e-=Na
B.可以用铁做阴极,石墨做阳极
C.烧碱和氯气都在阳极生成
D.离子交换膜是阴离子交换膜(只允许阴离子通过)
(2)苦卤的主要成分是 MgCl2,此外还含 Fe2+、Fe3+、Al3+等离子。已知:生成氢氧化物沉淀的 pH
氢氧化物 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 3.7 | 4.7 |
Mg(OH)2 | 9.6 | 11.1 |
① 步骤 i 中加入 NaClO 的作用是_____,_____。
② 步骤 ii 需在 HCl 保护气中加热进行,HCl 保护气的作用是_____。
③ 若向苦卤中加入石灰乳,可以得到 Mg(OH)2沉淀,用化学平衡移动原理解释该反应过程_____。
(3)海水淡化前需对海水进行预处理。用如图所示 NaClO 的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl 转化为NaClO 的离子方程式是_____,_____。
② 定量测定排出的海水中 Cl2 和 ClO-的含量。已知:2![]() +I2 =
+I2 =![]() +2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
+2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com