
【题目】海水是一个巨大的化学资源宝库。

(1)海水中制得的氯化钠可用于生产烧碱及氯气,装置如图所示,下列说法正确的是____(填字母)。

A.阴极反应式是:Na++e-=Na
B.可以用铁做阴极,石墨做阳极
C.烧碱和氯气都在阳极生成
D.离子交换膜是阴离子交换膜(只允许阴离子通过)
(2)苦卤的主要成分是 MgCl2,此外还含 Fe2+、Fe3+、Al3+等离子。已知:生成氢氧化物沉淀的 pH
氢氧化物 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Al(OH)3 | 3.7 | 4.7 |
Mg(OH)2 | 9.6 | 11.1 |
① 步骤 i 中加入 NaClO 的作用是_____,_____。
② 步骤 ii 需在 HCl 保护气中加热进行,HCl 保护气的作用是_____。
③ 若向苦卤中加入石灰乳,可以得到 Mg(OH)2沉淀,用化学平衡移动原理解释该反应过程_____。
(3)海水淡化前需对海水进行预处理。用如图所示 NaClO 的发生装置对海水进行消毒和灭藻处理。

① 装置中由NaCl 转化为NaClO 的离子方程式是_____,_____。
② 定量测定排出的海水中 Cl2 和 ClO-的含量。已知:2![]() +I2 =
+I2 =![]() +2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
+2I-。取 25.00 mL 排出的海水,加入过量 KI 溶液,然后用 a mol/LNa2S2O3 溶液滴定生成的 I2,达滴定终点时消耗Na2S2O3 溶液 b mL。该滴定操作选择的指示剂是_____,通过计算可知排出的 海水中 Cl2 和 ClO-的总物质的量浓度是_____mol/L。
【答案】B 把 Fe2+氧化成 Fe3+ 调 pH(至 4.7~9.6) 防止 MgCl2 水解 Ca(OH)2(s)Ca2+(aq) + 2OH-(aq),Mg2+与 OH-生成 Mg(OH)2 沉淀,OH-浓度减小,平衡正向移动 2Cl-+2H2O![]() Cl2
Cl2![]() +H2
+H2![]() +2OH- Cl2+ 2OH-=Cl-+ClO-+H2O 淀粉溶液 ab/50
+2OH- Cl2+ 2OH-=Cl-+ClO-+H2O 淀粉溶液 ab/50
【解析】
(1)根据电解氯化钠溶液的原理进行分析解答;
(2)根据Fe2+具有还原性,Fe3+、Al3+的沉淀Ksp及产生Fe(OH)3 和Al(OH)3的pH大小进行分析判断;根据Ksp[Mg(OH)2]<Ksp[Ca(OH)2]进行分析解答;
(3)根据电解饱和氯化钠溶液原理进行分析,根据原子守恒计算Cl2 和 ClO-的总物质的量浓度。
(1) A.由图可知,该装置是用来电解氯化钠溶液的装置,根据电极可知左侧为阳极,右侧为阴极,在阴极上发生还原反应的电极反应式为:2H2O+2e-=H2![]() +2OH-,故A错误;
+2OH-,故A错误;
B.在电解池中,阴极是被保护的电极,所以可以用铁做阴极,阳极能发生氧化反应,所以可用石墨做阳极,故B正确;
C.在电解池中,阳极能发生氧化反应,其电极反应式为:2Cl--2e-=Cl2![]() ,在阴极上发生还原反应,其电极反应式为:2H2O+2e-=H2
,在阴极上发生还原反应,其电极反应式为:2H2O+2e-=H2![]() +2OH-,所以氯气在阳极生成,烧碱在阴极生成,故C错误;
+2OH-,所以氯气在阳极生成,烧碱在阴极生成,故C错误;
D.因为Cl2能与烧碱反应,且阳极能发生氧化反应生成Cl2,阴极上发生还原反应生成烧碱,所以离子交换膜应是阳离子交换膜,故D错误;
故答案:B;
(2)①因为苦卤的主要成分是 MgCl2,此外还含 Fe2+、Fe3+、Al3+等离子,NaClO具有强氧化性,所以步骤 i是为了将Fe2+氧化成Fe3+;根据沉淀表可知需调节溶液的pH=4.7~9.6,即可除去Fe2+、Fe3+、Al3+杂质离子,故答案:把 Fe2+氧化成 Fe3+;调 pH(至 4.7~9.6);
②因为MgCl2溶液中存在Mg2++2H2O![]() Mg(OH)2+2H+,加热促进水解,所以步骤 ii 需在 HCl 保护气中加热进行,抑制MgCl2水解,故答案:防止 MgCl2 水解;
Mg(OH)2+2H+,加热促进水解,所以步骤 ii 需在 HCl 保护气中加热进行,抑制MgCl2水解,故答案:防止 MgCl2 水解;
③石灰乳的主要成分为Ca(OH)2,微溶于水,溶液中存在Ca(OH)2(s)Ca2+(aq) + 2OH-(aq);Mg(OH)2为难溶于水的沉淀,溶液中存在Mg(OH)2(s) Mg2+(aq) + 2OH-(aq),因为Ksp[Mg(OH)2]<Ksp[Ca(OH)2],Mg2+与OH-生成更难溶的Mg(OH)2 沉淀,OH-浓度减小,平衡正向移动,所以可以得到 Mg(OH)2沉淀,故答案:Ca(OH)2(s)Ca2+(aq) + 2OH-(aq),Mg2+与 OH-生成 Mg(OH)2 沉淀,OH-浓度减小,平衡正向移动;
(3)①首先是电解NaCl 溶液制取氯气,反应的离子方程式为:2Cl-+2H2O![]() Cl2
Cl2![]() +H2
+H2![]() +2OH-,生成的Cl2和氢氧化钠溶液反应生成NaClO,其反应的离子方程式为:Cl2+ 2OH-=Cl-+ClO-+H2O,故答案:2Cl-+2H2O
+2OH-,生成的Cl2和氢氧化钠溶液反应生成NaClO,其反应的离子方程式为:Cl2+ 2OH-=Cl-+ClO-+H2O,故答案:2Cl-+2H2O![]() Cl2
Cl2![]() +H2
+H2![]() +2OH-;Cl2+ 2OH-=Cl-+ClO-+H2O;
+2OH-;Cl2+ 2OH-=Cl-+ClO-+H2O;
②根据 2Na2S2O3+I2=2I-+Na2S4O6反应,碘遇淀粉变蓝的性质,所以该滴定过程选用的指示剂通常为淀粉溶液,判断滴定终点时的现象是:滴入最后一滴溶液,溶液蓝色褪色,且半分钟内不恢复,说明反应达到终点。利用消耗Na2S2O3的物质的量计算样品中Cl2 和 ClO-的总物质的量,根据Cl原子守恒即n(NaCl)=2n(Cl2)+n(ClO),由ClO-+2I-+2H+=Cl-+I2+H2O,2![]() +I2 =
+I2 =![]() +2I-,可知Cl2~ClO-~I2~2Na2S2O3,n(Na2S2O3)=amol/L
+2I-,可知Cl2~ClO-~I2~2Na2S2O3,n(Na2S2O3)=amol/L![]() ,所以n(Cl2)=n(ClO-)=
,所以n(Cl2)=n(ClO-)=![]() mol,所以排出的海水中 Cl2 和 ClO-的总物质的量浓度c=
mol,所以排出的海水中 Cl2 和 ClO-的总物质的量浓度c=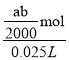 =
=![]() mol/L,故答案:淀粉溶液;
mol/L,故答案:淀粉溶液;![]() 。
。


科目:高中化学 来源: 题型:
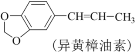
【题目】实验室利用反应: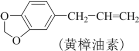
![]()
![]()
![]() 合成洋茉莉醛的流程如图所示。下列说法错误的是( )
合成洋茉莉醛的流程如图所示。下列说法错误的是( )
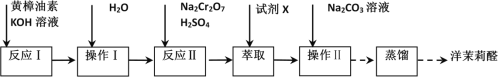
A.水洗的目的是除去KOH
B.试剂X应选用有机溶剂
C.黄樟油素和异黄樟油素互为同分异构体
D.进行蒸馏操作时可选用球形冷凝管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列过程的离子方程式不正确的是
A.K2Cr2O7 溶液中加入浓 NaOH 溶液后变黄:![]() +H2O
+H2O![]() 2
2![]() +2H+
+2H+
B.明矾溶于水产生Al(OH)3 胶体:Al3++3H2O![]() Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+
C.用碳酸钠溶液处理锅炉水垢中的硫酸钙:CaSO4+![]() ==CaCO3+
==CaCO3+![]()
D.向Ca(HCO3)2 溶液中滴加少量 NaOH 溶液生成白色沉淀:Ca2++2![]() +2OH-=CaCO3↓+
+2OH-=CaCO3↓+![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 mY(g)+nZ(g)qX(g) ΔH,在不同温度下的平衡体系中,物质 Y 的体积分数随压强变化的曲线如图所示。下列说法正确的是
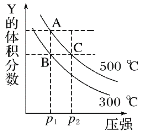
A.m+n<q
B.该反应的ΔH>0
C.A、C 两点化学平衡常数:KA>KC
D.B、C 两点的反应速率:v(B)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表的一部分,请用元素符号、离子符号或相关化学式回答有关问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中能形成两性氢氧化物的元素在周期表中的位置是________;
(2)写出②的气态氢化物的结构式________;
(3)元素④⑤⑥⑦离子半径由大到小的顺序________;
(4)①、⑥、⑦三种元素的最高价氧化物的水化物中酸性最强的是________;④、⑤、⑨三种元素的最高价氧化物的水化物中碱性最强的是
(5)⑦和⑩氧化性较强的是________用一个置换反应证实这一结论(写化学方程式)___________________________。
(6)④⑤两元素相比较,金属性较强的是________,可以验证该结论的实验是________;
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质用砂纸打磨后分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质用砂纸打磨后分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法正确的是
N2(g)+2CO2(g)。下列说法正确的是
A.升高温度可使该反应的逆反应速率降低
B.达到化学平衡时,化学反应已经停止
C.v正(NO)=v正(CO2)时,说明达到了化学平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
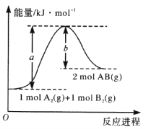
A. 每生成2 mol AB吸收bkJ热量
B. 该反应热△H= + (a-b)kJ mol-1
C. 该反应中反应物的总能量高于生成物的总能量
D. 断裂1 mol A—A和1 mol B—B键,放出akJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的某磁黄铁矿(主要成分FexS,S为-2价)与100mL盐酸恰好完全反应(矿石中其他成分不与盐酸反应),生成3.2g硫单质、0.4molFeCl2和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A.该盐酸的物质的量浓度为4.0mol·L-1
B.该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为2:1
C.生成的H2S气体在标准状况下的体积为8.96L
D.该磁黄铁矿中FexS的x=0.85
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com