
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
【答案】将镍废料磨成粉末(或搅拌,或适当升高温度,或提高酸的浓度) H2O2+2Fe2++2H+=2Fe3++2H2O 4.7≤pH<7.1或[4.7,7.1) 17.5 蒸发浓缩、冷却结晶
【解析】
根据流程:金属镍废料(含Fe、Al等杂质),加盐酸酸浸后的酸性溶液中主要含有H+、Ni2+、Fe2+、Al3+,加入过氧化氢氧化亚铁离子为铁离子,反应为:H2O2+2Fe2++2H+=2Fe3++2H2O,加入Na2CO3溶液调节溶液的pH范围4.7≤pH<7.1,使Fe3+、Al3+全部沉淀,滤渣为Fe(OH)3、Al(OH)3,滤液主要含有Ni2+,加入Na2CO3溶液沉淀Ni2+,将得到的NiCO3沉淀用盐酸溶解得到二氧化碳和NiCl2溶液,将NiCl2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NiCl26H2O,据此分析作答。
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有将镍废料磨成粉末、搅拌、适当升高温度方法、提高溶液中酸的浓度,都可以提高镍元素的浸出率;
(2)H2O2具有氧化性,加入H2O2氧化Fe2+为Fe3+,离子方程式为: H2O2+2Fe2++2H+=2Fe3++2H2O;
(3)“调pH”的目的是沉淀Fe3+、Al3+,但不沉淀Ni2+,根据表格数据可知,应该控制溶液pH的范围为4.7≤pH<7.1或[4.7,7.1);
(4)滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中含有n(Ni2+)=0.1mol,则生成NiCO3需要CO32-为0.1mol,Ni2+刚好沉淀完全时,溶液中c(CO32-)=![]() =0.65mol/L,此时溶液中CO32-为0.065mol,故至少需要Na2CO3固体0.1mol+0.065mol=0.165mol,其质量m(Na2CO3)=0.165mol×106g/mol=17.49g≈17.5g;
=0.65mol/L,此时溶液中CO32-为0.065mol,故至少需要Na2CO3固体0.1mol+0.065mol=0.165mol,其质量m(Na2CO3)=0.165mol×106g/mol=17.49g≈17.5g;
(5)将NiCl2溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到NiCl26H2O。


科目:高中化学 来源: 题型:
【题目】2019年厦门大学王野教授课题组在合成气(主要成分CO和H2)催化转化制乙醇方面实施可控接力催化,按照:合成气→甲醇→乙酸→乙醇的方式,成功实现乙醇的高选择性合成。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+
O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+![]() O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+
O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+![]() O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
则工业上利用合成气制备甲醇的可逆反应热化学方程式为______________________;
(2)恒温恒容条件下,下列能说明合成气制甲醇的反应已达平衡状态的是_______;
A.单位时间内生成n mol CO的同时生成2n mol H2
B. v(H2)正= 2v(CH3OH)逆
C.容器内气体的密度保持不变
D.容器中气体的平均摩尔质量保持不变
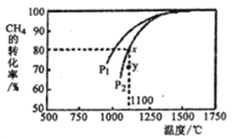
(3)利用天然气制取合成气的原理为: CO2(g)+CH4(g)= 2CO(g)+ 2H2(g),在密闭容器中通入物质的量浓度均为0.1 molL-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1______P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正)_____v(逆) (填“大于”、“小于”或“等于”),求Y点对应温度下的该反应的平衡常数K=________ (计算结果保留两位有效数字)。
(4)以二氧化钛表面覆盖CuAlO4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250-300°C时,温度升高面乙酸的生成速率降低的原因是____;
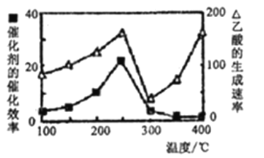
②为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
(5)一定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与b mol/ Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系错误的是( )
A.CH3CH2CH2CH2CH3和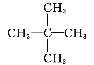 互为同分异构体
互为同分异构体
B.干冰和冰不是同一种物质
C.CH2 =CH2和CH2=CHCH3互为同系物
D.C4H10的一氯代物有三种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某种光电池中,当光照在表面涂有氯化银的银片上时,发生反应:AgCl(s)![]() Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:Cl(AgCl)+e-=Cl-(aq)+AgCl(s)。如图为用该光电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是( )
Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:Cl(AgCl)+e-=Cl-(aq)+AgCl(s)。如图为用该光电池电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图,下列叙述正确的是( )

A.光电池工作时,Ag极为电流流出极,发生氧化反应
B.制氢装置溶液中K+移向A极
C.光电池工作时,Ag电极发生的反应为2Cl--2e-=Cl2↑
D.制氢装置工作时,A极的电极反应式为CO(NH2)2+8OH-6e-=CO32-+6H2O+N2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
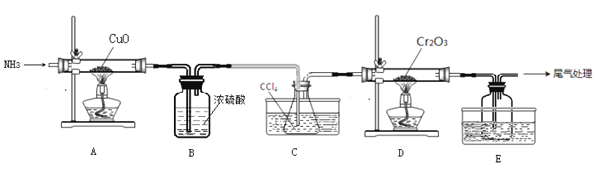
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为研究化学能与电能的转化,设计下图装置。下列叙述错误的是

A.a和b不连接时,铁片上会有气泡产生
B.无论a和b是否连接,铁片均发生氧化反应
C.a和b用导线连接时,溶液中H+向铁片移动
D.a和b用导线连接时,铜片上发生的反应为2H++2e-== H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】间硝基苯胺是一种重要的有机合成中间体,它是一种黄色针状晶体,微溶于冷水,在水中的溶解度随温度升高而增大,易溶于乙醇、乙醚、甲醇等。实验室制备间硝基苯胺的反应原理及装置如下(夹持及加热装置略去):
4 +6NaHS+H2O→4
+6NaHS+H2O→4 +3Na2S2O3
+3Na2S2O3

实验步骤:
①硫氢化钠溶液的制备。将0.05molNa2S9H2O溶于25mL水中,分批加入4.2gNaHCO3粉末,完全溶解后,慢慢加入30ml.甲醇,冰水浴冷却,立即析出一水合碳酸钠。静置,抽滤,滤饼用15mL甲醇分三次洗涤,合并滤液和洗涤液备用。
②间硝基苯胺的制备。在A中将0.03 mol间二硝基苯溶于40 mL热甲醇中,装上B,从B的顶端加入上述硫氢化钠溶液,水浴加热回流20min。冷却至室温后,改为蒸馏装置,蒸出大部分甲醇,将残液倾入150mL冷水中,立即析出间硝基苯胺粗品,抽滤,洗涤,重结晶,脱色后,得黄色的间硝基苯胺针状晶体2.4 g。回答下列问题:
(1)仪器B的名称是________, 使用时要从_____(填“ a”或“b”)口通入冷水;滴液漏斗的细支管c的作用是________。
(2)写出步骤①中总反应的离子方程式:____________。
(3)步骤①中合并洗涤液的目的是________。
(4)步骤②中制备装置改为蒸馏装置,需增加的仪器除了蒸馏头、温度计、尾接管之外,还有________、________。
(5)步骤②中蒸出大部分甲醇的目的是__________。
(6)步骤②中洗涤粗品使用的洗涤剂为_____;粗品脱色使用的脱色剂可以是______。
(7)本实验的产率为______[保留 2位有效数字;Mr(间硝基苯胺) = 138]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,碘在某液态有机物M和水之间的分配比D=85(分配比D=![]() ),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
),向两个装有20mL 0.1mol/L I2的水溶液的锥形瓶中各加入20mL、40mL M,充分振荡后静置。下列说法正确是
A.锥形瓶中水层为无色,M层为紫色,
B.20mL中M层的I2浓度约为0.099mol/L
C.I2单质溶于有机物M时需要断裂化学键
D.40mL中M层的I2浓度大于20mL中M层的I2浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com