
【题目】2019年厦门大学王野教授课题组在合成气(主要成分CO和H2)催化转化制乙醇方面实施可控接力催化,按照:合成气→甲醇→乙酸→乙醇的方式,成功实现乙醇的高选择性合成。
(1)已知:①H2(g)+![]() O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+
O2(g)=H2O(g) △H1=-285.8KJ/mol;②CO(g)+![]() O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+
O2(g)=CO2(g) △H2=-283KJ/mol;③CH3OH(g)+![]() O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
O2(g)= CO2(g)+2 H2O(l) △H3=-764.6 KJ/mol;
则工业上利用合成气制备甲醇的可逆反应热化学方程式为______________________;
(2)恒温恒容条件下,下列能说明合成气制甲醇的反应已达平衡状态的是_______;
A.单位时间内生成n mol CO的同时生成2n mol H2
B. v(H2)正= 2v(CH3OH)逆
C.容器内气体的密度保持不变
D.容器中气体的平均摩尔质量保持不变
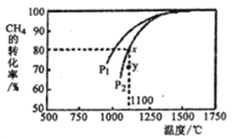
(3)利用天然气制取合成气的原理为: CO2(g)+CH4(g)= 2CO(g)+ 2H2(g),在密闭容器中通入物质的量浓度均为0.1 molL-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图所示,则压强P1______P2 (填“大于”或“小于”);压强为P2时,在Y点:v(正)_____v(逆) (填“大于”、“小于”或“等于”),求Y点对应温度下的该反应的平衡常数K=________ (计算结果保留两位有效数字)。
(4)以二氧化钛表面覆盖CuAlO4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250-300°C时,温度升高面乙酸的生成速率降低的原因是____;
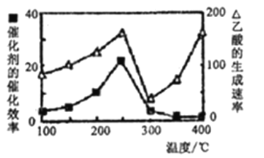
②为了提高该反应中CH4的转化率,可以采取的措施是_____________________;
(5)一定条件下,甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH溶液与b mol/ Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示,该混合溶液中醋酸的电离常数为________。
【答案】CO(g)+2H2(g)CH3OH(g) △H3=-90KJmol-1 BD 小于 大于 1.6mol2/L2 温度超过250℃时,催化剂的催化效率降低 增大反应压强或增大CO2的浓度 ![]()
【解析】
(1)工业上利用合成气CO和H2制备甲醇,根据盖斯定律,①×2+②-③可得CO(g)+2H2(g)CH3OH(g) △H=2△H1+△H2-△H3=2×(-285.8KJ/mol)+(-283KJ/mol)-(-764.6 KJ/mol)=-90KJmol-1;
(2)恒温恒容条件下A.单位时间内生成n mol CO的同时生成2n mol H2,只有逆反应,不能说明达到平衡,可以改为单位时间内生成n mol CO的同时消耗2n mol H2,;B.不同物质的正逆化学反应速率呈系数比,v(H2)正= 2v(CH3OH)逆,可以说明达到平衡;C.容器内气体的密度始终为定值不变,故密度保持不变不能说明达到平衡,错误;D.容器中气体的平均摩尔质量会逐渐增大,当达到平衡,平均摩尔质量保持不变,可以说明达到平衡,以此以上能说明合成气制甲醇的反应已达平衡状态BD;
(3)CH4的平衡转化率-T-P,在相同条件下保持温度不变,增大压强平衡向气体粒子数目减小的方向移动,该反应逆向移动,CH4的平衡转化率降低,故压强越大平衡转化率越低,P1平衡转化率高,故压强P1>P2 ;压强为P2时,x点为平衡状态,y点未达到平衡,且此时产率低于平衡时刻,故向正向移动,v(正)>v(逆);在密闭容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,x点对应的平衡转化率为80%,可得平衡时c (CH4)=c(CO2)= 0.02 mol·L-1,c (H2)=c(CO)= 0.16 mol·L-1,x点与y点温度相同,故平衡常数相同,因此y点对应的平衡常数K==![]() ;
;
(4)①由图可知,温度超过250℃时,催化剂的催化效率降低;
②CH4+ CO2CH3COOH,增大反应压强平衡正移,可以提高甲烷转化率;增大CO2的浓度平衡正移,可以提高甲烷的转化率;
(5)常温条件下,将a mol·L-1CH3COOH溶液与b mol·L-1Ba(OH)2溶液等体积混合, c(Ba2+)为原来浓度的一半,2c(Ba2+)=c(CH3COO-)=b,c(CH3COOH)=![]() a-b,且根据电荷守恒溶液呈中性,混合溶液中醋酸的电离常数为K=
a-b,且根据电荷守恒溶液呈中性,混合溶液中醋酸的电离常数为K=![]() =
=![]() =
=![]() 。
。


科目:高中化学 来源: 题型:
【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
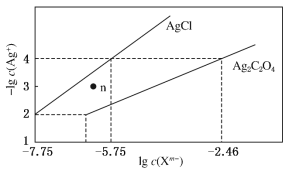
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0 gCu投入50mL 12moL/L的浓硝酸中,充分反应后,收集到4.48L(标准状况)NO和NO2的混合气体。
(1)被还原硝酸的物质的量是_________mol。
(2)判断32.0gCu和50mL 12moL/L的硝酸反应后有剩余的是______________,剩余的物质物质的量为____________________,生成的NO气体体积为(标况下)_________________。
(3)如果往反应后的体系内再加入100mL2mol/L的稀硫酸,充分反应后又有气体逸出。写出反应的离子方程式并用单线桥法表示电子转移的方向和数目 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
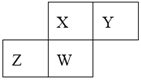
A.最高价氧化物对应水化物的酸性:X>W>Z
B.最简单气态氢化物的热稳定性:Y>X>W>Z
C.原子半径:W>Z>Y>X
D.元素X、Z、W的最高正化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 |
乙醇 | -144 | 78.0 | 0.789 |
乙酸 | 16.6 | 118 | 1.05 |
乙酸乙酯 | -83.6 | 77.5 | 0.900 |
浓硫酸(98%) | - | 338 | 1.84 |
下图为实验室制取乙酸乙酯的装置图。

(1)当饱和碳酸钠溶液上方收集到较多液体时,停止加热,取下小试管B,充分振荡,静置。振荡前后的实验现象为________(填字母)。
A.上层液体变薄 B.下层液体红色变浅或变为无色 C.有气体产生 D.有果香味
(2)为分离乙酸乙酯、乙醇、乙酸的混合物,可按下列步骤进行分离:

①试剂1最好选用_________________________________________________;
②操作1是________,所用的主要仪器名称是__________________________;
③试剂2最好选用_____________________________________;
④操作2是_______________________________________;
⑤操作3中温度计水银球的位置应为下图中________(填“a”“b”“c”或“d”)所示,在该操作中,除蒸馏烧瓶、温度计外 、锥形瓶 ,还需要的玻璃仪器有__________、________、________,收集乙酸的适宜温度是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)的最重要用途是作为铁合金的添加剂,用CO还原MoO3制备单质Mo的装置如图所示(尾气处理装置已省略)。下列说法正确的是

A.装置①用于制备CO2,其中石灰石可用纯碱替代
B.装置②中盛有饱和碳酸钠溶液,以除去CO2中的HCl气体
C.在装置④中生成了钼单质
D.装置⑥中的现象不能达到检验MoO3是否被CO还原的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源,在实验室中模拟工业上以金属镍废料(含Fe、Al等杂质)为原料生产NiCl2的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 2.1 | 6.5 | 3.7 | 7.1 |
沉淀完全的pH | 3.3 | 9.7 | 4.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有__________(写一条即可)。
(2)加入H2O2时发生主要反应的离子方程式为__________。
(3)“调pH”时,控制溶液pH的范围为__________。
(4)“沉镍”过程中,若滤液A中c(Ni2+)=1.0mol/L,欲使100mL该滤液中的Ni2+沉淀完全[即溶液中c(Ni2+)≤1.0×10-5],则需用托盘天平称取Na2CO3固体的质量至少为_____g。(已知Ksp(NiCO3)=6.5×10-6,忽略溶液体积的变化)
(5)流程中由溶液得到NiCl2·6H2O的实验操作步骤依次为______、过滤、洗涤、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com