
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_____。
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为___。(不用写反应条件)
(3)下列属于乙醇的同系物的是___,属于乙醇的同分异构体的是____。(选填编号)
A.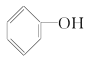 B.
B.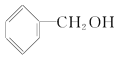 C.CH3CH2—O—CH2CH3
C.CH3CH2—O—CH2CH3
D.CH3OH E.CH3—O—CH3 F.HO—CH2CH2—OH
(4)乙醇能够发生氧化反应:
①乙醇在铜作催化剂的条件下可被氧气氧化,反应的化学方程式为________。
②46g乙醇完全燃烧消耗___mol氧气。
③下列说法正确的是___(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.实验室制乙烯时,温度控制在140℃
C.黄酒中某些微生物将乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应
【答案】小 CH2=CH2+H2O![]() CH3CH2OH D E 2C2H5OH+O2
CH3CH2OH D E 2C2H5OH+O2![]() 2CH3CHO+2H2O 3 CD
2CH3CHO+2H2O 3 CD
【解析】
(1)乙醇密度比水小;
(2)乙烯中含双键可和水发生加成反应生成乙醇;
(3)根据同系物及同分异构体的概念分析;
(4)乙醇含有羟基,可发生催化氧化,可燃烧,可发生取代反应和消去反应,以此解答该题。
(1)乙醇是无色具有特殊香味的密度比水小液体;
(2)乙烯中含双键可和水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O![]() CH3CH2OH;
CH3CH2OH;
(3)结构相似,在组成上相差若干个CH2原子团的物质互称同系物,故乙醇的同系物有甲醇,合理选项是D;
分子式相同结构不同的有机物互称同分异构体,乙醇的同分异构体为甲醚,合理选项是E;
(4)①乙醇在铜作催化剂的条件下加热,可被氧气氧化为乙醛,反应的化学方程式为2C2H5OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
②46 g乙醇的物质的量n(C2H5OH)=46 g÷46 g/mol=1 mol,根据乙醇燃烧的方程式:C2H5OH+3O2![]() 2CO2+3H2O,可知1 mol乙醇完全燃烧消耗3 mol氧气;
2CO2+3H2O,可知1 mol乙醇完全燃烧消耗3 mol氧气;
③A.乙醇含有羟基,能和酸性高锰酸钾溶液发生氧化还原反应使酸性高锰酸钾溶液褪色,A错误;
B.实验室制乙烯时,温度控制在170℃,B错误;
C.黄酒中某些微生物将乙醇氧化为乙酸,乙酸具有酸性,于是酒就变酸了,C正确;
D.陈年的酒很香是由于乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了具有特殊香味的乙酸乙酯,因此而具有香味,D正确;
故合理选项是CD。


科目:高中化学 来源: 题型:
【题目】下列有机化学反应方程式及反应类型均正确的是
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 酯化反应 |
B | CH4+Cl2 | 置换反应 |
C | CH2=CH2+Br2 CH3CHBr2 | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
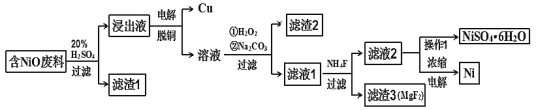
已知:有关金属离子生成氢氧化物沉淀所需的pH如图:

(1)滤渣1的主要成分为____。
(2)①用离子方程式解释加入H2O2的作用____。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为____。
(3)从滤液2中获得NiSO4·6H2O的实验操作是____、过滤、洗涤、干燥。
(4)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图如图:
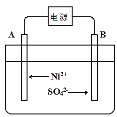
①B极附近pH会____(填“增大”、“减小”或“不变”);用平衡移动原理解释B极附近pH变化的原因:____。
②一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质只含C、H、O三种元素,其分子的球棍模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。

(1)该物质中含氧官能团的结构简式为________。
(2)下列物质中,与该物质互为同分异构体的是________(填序号)。
A.CH3CH2CH2COOH
B.OHCCH(CH3)CHO
C.CH3CH2CH===CHCOOH
D.CH2===CHCOOCH3
(3)该分子中共平面的原子数最多为________(已知羧基的四个原子可以共平面)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-====4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2====2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学准备用下图所示装置制取H2还原氧化铜,在实验中发现稀硫酸不足,与锌粒无法接触而又无其他酸液可加入,经思考后他从长颈漏斗中加入适量的合适试剂完成了实验,下列试剂中不合适的是
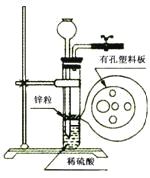
A.苯B.四氯化碳C.酒精D.KCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子,该分子中A、B两种元素都只有3个能层,分子中所有原子的最外层都达到8个电子的稳定结构。下列说法不正确的是
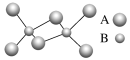
A.元素A位于元素周期表第三周期第ⅢA族
B.该化合物是共价化合物,在熔融状态下能导电
C.该化合物在固态时所形成的晶体是分子晶体
D.该化合物中存在极性共价键,无非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的轨道表示式为_________,基态S原子电子占据最高能级的电子云轮廓图为________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是____________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为___________。
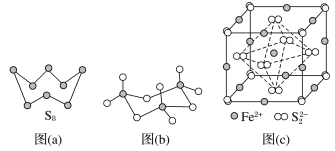
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为____________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M对霉菌有较好的抑制作用,结构简式为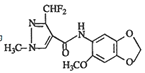 ,其合成路线如图所示:
,其合成路线如图所示:
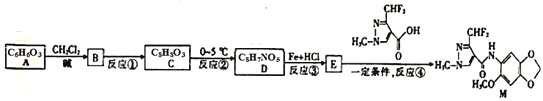
已知: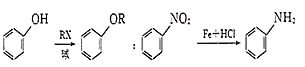
回答下列问题:
(1)化合物B的分子式为___;D中官能团的名称为__。
(2)反应②的反应类型是__。
(3)化合物E的结构简式为___。
(4)写出A与足量溴水反应的化学方程式:__。
(5)写出符合下列条件的D的同分异构体__(填结构简式,写出一种即可)。
①含有硝基和羰基,且分别和苯环直接相连;
②能与FeCl3溶液发生显色反应;
③核磁共振氢谱显示有3组峰,且峰面积之比为2:2:3。
(6)请以![]() 、
、![]() 为原料合成化合物
为原料合成化合物![]() ,写出制备的合成路线流程图。(无机试剂任用)__。
,写出制备的合成路线流程图。(无机试剂任用)__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com