
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。请回答:
(1)Cu、Zn在周期表中________区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式___________。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因为_________________。
②溶液中的水存在H3O+、![]() 等微粒形式,
等微粒形式,![]() 可看作是H3O+与H2O通过氢键形成的离子,则
可看作是H3O+与H2O通过氢键形成的离子,则![]() 的结构式为___________。
的结构式为___________。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:

①1 mol M含有的σ键的数目为___________。
②常见含氮的配体有 H2NCH2 COOˉ、NH3、![]() 等,NH3的分子空间构型为____________,
等,NH3的分子空间构型为____________,![]() 的中心氮原子杂化方式为__________。
的中心氮原子杂化方式为__________。
③M在人体内吸收率高的原因可能是锌形成配合物后,电荷__________(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ ZnX2 | ZnF2 | ZnCl2 | ZnBr2 |
熔点/℃ | 872 | 283 | 394 |
则ZnX2熔点如表变化的原因是____________________。
(5)Zn的某种硫化物的晶胞如图所示。已知S2-和Zn2+的半径分别为r1 pm、r2 pm,且S2-与Zn2+相切,NA为阿伏加德罗常数的值。则该晶体的密度为________g·cm-3(写计算表达式)。

【答案】ds [Ar]3d104p1 由于Cu2+对配体NH3的孤电子对吸引力大,配位键强 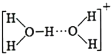 20NA 三角锥形 sp杂化 变少 ZnF2为离子晶体,熔点最高;ZnCl2、ZnBr2分子晶体,ZnBr2的相对分子质量大,分子间作用力,熔沸点较高
20NA 三角锥形 sp杂化 变少 ZnF2为离子晶体,熔点最高;ZnCl2、ZnBr2分子晶体,ZnBr2的相对分子质量大,分子间作用力,熔沸点较高 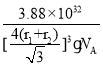
【解析】
(1)Cu为29号元素,Zn为30号元素,据此分析其在元素周期表中的位置;
(3)①单键均为σ键,双键或三键中有一个σ键,配位键为σ键;
②根据价层电子对互斥理论判断空间构型,根据等电子体理论判断杂化方式;
(4)先判断晶体类型,离子晶体的熔点与晶格能有关;分子晶体的熔点与分子间作用力有关;
(5)先根据晶胞半径计算晶胞棱长,确定晶胞体积,再根据均摊法确定晶胞内各原子的数目,确定晶胞质量,根据![]() 计算密度。
计算密度。
(1)Cu为29号元素,位于周期表中第4周期第ⅠB族,为ds区元素,Zn在周期表中位于第4周期ⅡB族,属于ds区元素,Cu的核外电子排布式为[Ar]3d104s1,焰色反应时 Cu 的 4s 电子会跃迁至 4p 轨道,则Cu 的激发态电子排布式为:[Ar]3d104p1或1s22s22p63s23p63d104p1;
(2)①由于Cu2+对配体NH3的孤电子对吸引力大,配位键强,所以NH3与Cu2+形成配合物的能力大于Mg2+;
②H5O2+可看作是H3O+与H2O通过氢键形成的离子,结构式为: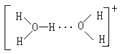 ;
;
(3)①C—C单键、C—H单键、N—C单键、C—O单键、N—H单键均为σ键,C=O双键中有一个σ键,O原子、N原子与Zn之间的配位键为σ键,所以1个M含有20个σ键,所以1molM含有的σ键个数为20NA;
②NH3分子中心原子的价层电子对数为![]() =4,含一对孤电子对,所以为三角锥形;
=4,含一对孤电子对,所以为三角锥形;![]() 与CO2原子总数相同,价电子总数相同,二者互为等电子体,CO2为直线形分子,C原子为sp杂化,所以
与CO2原子总数相同,价电子总数相同,二者互为等电子体,CO2为直线形分子,C原子为sp杂化,所以![]() 中心 N 原子杂化方式为sp杂化;
中心 N 原子杂化方式为sp杂化;
③M 在人体内吸收率高的原因可能是锌形成配合物后,电荷变少,可在消化道内维持良好的稳定性;
(4)由表中熔点数据可知,ZnF2与其他两种的晶体类型不同,ZnF2为离子晶体,熔点最高;ZnCl2、ZnBr2为分子晶体,ZnBr2的相对分子质量大,分子间作用力,熔沸点较高;
(5)根据该硫化物的晶胞结构可知,S2-位于Zn2+的正四面体中心,根据几何关系,晶胞的体对角线为S2-和Zn2+的半径之和的4倍,设晶胞的棱长为a,则有![]() a=4(r1+r2),所以晶胞棱长a=
a=4(r1+r2),所以晶胞棱长a=![]() pm,则晶胞的体积V=
pm,则晶胞的体积V=![]() pm3;根据均摊法,晶胞内Zn2+的个数为
pm3;根据均摊法,晶胞内Zn2+的个数为![]() =4,S2-的个数为4,所以晶胞的质量m=
=4,S2-的个数为4,所以晶胞的质量m=![]() ,所以晶体的密度为ρ=
,所以晶体的密度为ρ=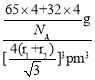 =
=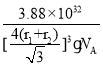 g·cm-3。
g·cm-3。


 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】有以下合成路线(部分反应条件已省略),下列有关说法错误的是

A.物质A的名称为乙炔,其电子式为![]()
B.物质B中所有原子可能共平面
C.物质C的同分异构体中含有苯环且苯环上有两个取代基的有3种
D.反应③的反应条件为O2、Cu加热,反应类型为氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,问:
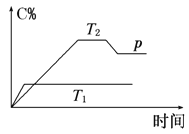
(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡___ _____移动(填“向正反应方向”“向逆反应方向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吉林某化工厂发生爆炸,导致1个硝基苯储罐、2个苯储罐报废,导致苯酚、苯胺停产。爆炸过程还产生了大量的浓烟和强烈的刺激性气味,造成了空气污染。
(1)写出上述材料中提到的4种有机物中,任意两种有机物的结构简式①_______,②_________。
(2)爆炸过程中,产生了大量黑烟,其原因是_____________
(3)上述爆炸事故附近的江水有强烈苦杏仁气味,苯、硝基苯、二甲苯等主要污染物指标均超过国家标准。具有苦杏仁味的有机物是________,它在江水中的主要存在形式是___________。
(4)硝基苯是制造染料的重要原料,但是硝基苯进入人体,严重危害人体健康,写出实验室由苯制取硝基苯反应的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在101kPa时,H2在1mol O2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热为___,表示H2燃烧热的热化学方程式为___。
(2)①已知:CH4(g)+H2O(g)=CO(g)+3H2(g) △H= +206.2kJ·mol-1,CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=+247.4kJ·mol-1,则以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:____。
②由气态基态原子形成1mol化学键释放的最低能量叫键能。已知表中所列键能数据,则N2(g)+3H2(g)![]() 2NH3(g) △H=__kJ·mol-1。
2NH3(g) △H=__kJ·mol-1。
化学键 | H-H | N-H | N≡N |
键能kJ·mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
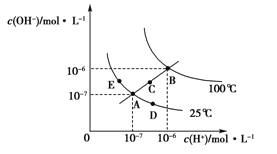
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸、碱、盐都是电解质,在水中都能电离出离子。根据下列化合物:①NaOH ②CH3COOH ③NH4Cl ④NH3·H2O ⑤CH3COONa,请回答下列问题:
(1)上述几种电解质中属于弱电解质的是______________
(2)常温下pH=2的CH3COOH溶液中由水电离产生的 c(OH-) =_____________________
(3)写出CH3COOH的电离方程式_______________________
(4)将等pH等体积的NaOH和NH3·H2O分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m ___________n (填“大于、等于或小于”)
(5)pH=12的NaOH溶液100mL,要使它的pH为11,如果加0.01mol/L HCl,应加_______mL。(体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,发生可逆反应2NO(g)+O2(g)![]() 2NO2(g),不能说明该反应已经达到平衡状态的是
2NO2(g),不能说明该反应已经达到平衡状态的是
A. 正反应生成NO2的速率和逆反应生成NO的速率相等
B. 反应容器中压强不随时间的延长而变化
C. 混合气体颜色深浅保持不变
D. 混合气体的密度不随时间延长而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com