
【题目】下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)

A.图1:n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
B.图2:n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
C.图3:n(HCl)=1mol时,K2CO3逐步加入到HCl溶液中在敞口容器反应生成的气体
D.图4:n(HNO3)=1mol时,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
【答案】A
【解析】
试题分析:A、因开始氧气过量,则发生C+O2![]() CO2,n(O2)=1mol,生成二氧化碳为1mol,然后发生CO2+C
CO2,n(O2)=1mol,生成二氧化碳为1mol,然后发生CO2+C![]() 2CO,则生成2molCO,图象与反应相符合,故A正确;B、因开始碱过量,则发生CO2+2NaOH═Na2CO3+H2O,n(NaOH)=1mol时生成0.5molNa2CO3,再加人二氧化碳发生Na2CO3+H2O+CO2═2NaHCO3,则最终碳酸钠减少为0,碳酸氢钠生成1mol,图象与反应不符,故B错误;C、因开始反应时盐酸过量,则发生K2CO3+2HCl═2KCl+H2O+CO2↑,n(HCl)=1mol时生成0.5mol二氧化碳后再加盐酸不反应,气体不会减少,图象与反应不符,故C错误;D、因开始硝酸过量,则发生Fe+4HNO3═Fe(NO3)3+NO↑+H2O,n(HNO3)=1mol时生成0.25mol Fe(NO3)3,图象与反应不符,故D错误;故选A。
2CO,则生成2molCO,图象与反应相符合,故A正确;B、因开始碱过量,则发生CO2+2NaOH═Na2CO3+H2O,n(NaOH)=1mol时生成0.5molNa2CO3,再加人二氧化碳发生Na2CO3+H2O+CO2═2NaHCO3,则最终碳酸钠减少为0,碳酸氢钠生成1mol,图象与反应不符,故B错误;C、因开始反应时盐酸过量,则发生K2CO3+2HCl═2KCl+H2O+CO2↑,n(HCl)=1mol时生成0.5mol二氧化碳后再加盐酸不反应,气体不会减少,图象与反应不符,故C错误;D、因开始硝酸过量,则发生Fe+4HNO3═Fe(NO3)3+NO↑+H2O,n(HNO3)=1mol时生成0.25mol Fe(NO3)3,图象与反应不符,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】下列物质转换关系如下图,反应的条件和部分产物已略去。回答下列问题:

(1)若甲、乙是两种常见金属,反应Ⅲ的实验现象是苍白色火焰,瓶口出现白雾。
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种强腐蚀性的物质,则工业上生产甲的一般方法是______。(填序号)
A.热分解法
B.热还原法
C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是_______________________。
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性______(填“强”或“弱”),比较二者金属性强弱的依据还可以是__________________(写出一种即可)。
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应。
①反应Ⅲ的离子方程式是_____________________。
②反应I的另一种产物为有机物,则该有机物的电子式是___________。
③已知次氯酸的酸性弱于碳酸,则在饱和氨水中加入少量石灰石,其反应的离子方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是

A. 图1中电解质溶液的pH增大
B. 图2中电解AlCl3溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. A处通入的气体为CH4,电极反应式为CH4+10OH--8e-=CO32-+7H2O
D. 电解池中Cl-向x极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸是实验室常用的一种化学试剂,某乙酸试剂瓶上标签的部分内容如图所示。利用标签提供的信息,回答下列问题:
(1)乙酸的摩尔质量为 。
(2)若该乙酸溶液的密度为1.02g/cm3,求此乙酸溶液的物质的量浓度。
(3)某实验中要用2 mol·L-1的乙酸溶液306ml,则需取用上述乙酸溶液多少毫升进行稀释?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸 (H2C2O4)在60℃时反应制得,某学生拟用下图所示的装置模拟制取并收集ClO2。
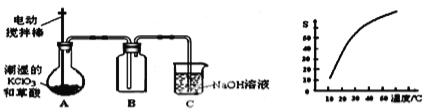
(1)B必须放在冰水浴中控制温度,其原因是_______________。
(2)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO23H2O,在温度高于38℃时析出晶体是NaClO2 。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______;b_______;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
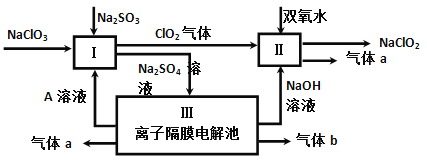
①I、III中发生反应的还原剂分别是_____、_____(填化学式)。
②Ⅱ中反应的离子方程式是___________。
③ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式______。
④NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量_______。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积、温度都相同的条件下,反应2A(g)+2B(g) ![]() C(g)+3D(g)分别从下列两条途径建立平衡:
C(g)+3D(g)分别从下列两条途径建立平衡:
Ⅰ.A、B的起始物质的量均为2 mol;
Ⅱ.C、D的起始物质的量分别为2 mol和6 mol。
以下叙述中不正确的是
A.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同
B.Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的平均相对分子质量相同
C.达平衡时,Ⅰ途径的反应速率vA等于Ⅱ途径的反应速率vA
D.达平衡时,Ⅰ途径所得混合气体的密度为Ⅱ途径所得混合气体密度的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积),关于该固体混合物,下列说法正确的是

A.一定含有Al,其质量为4.05g
B.一定不含FeCl2,可能含有MgCl2和AlCl3
C.一定含有MgCl2和FeCl2
D.一定含有(NH4)2SO4、MgCl2,且物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在2L的密闭容器中充入2molSO2和一定量的O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到前2min末时,容器中n(SO2)为
2SO3(g),进行到4min时,测得n(SO2)=0.4mol,若反应进行到前2min末时,容器中n(SO2)为
A.1.6mol B.1.2mol
C.大于1.6mol D.小于1.2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com