
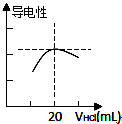
 某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:| c(酸)×V(酸) |
| V(碱) |
| 0.10mol?L-1×100mL |
| 10mL |


科目:高中化学 来源: 题型:
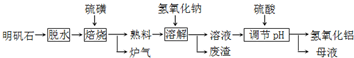
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1NaHCO3溶液与0.1mol?L-1 NaOH溶液 |
| B、0.1mol?L-1NaHSO4溶液与0.1mol?L-1 Ba(OH)2溶液 |
| C、0.2mol?L-1氨水与0.1mol?L-1盐酸 |
| D、0.1mol?L-1氨水与0.1mol?L-1盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一次滴定 | 第二次滴定 | 第三次滴定 | |
| 待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
| 标准溶液体积(mL) | 9.99 | 10.01 | 10.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
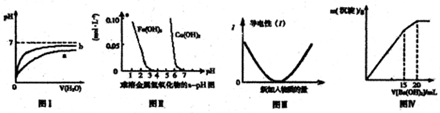
| A、图Ⅰ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线b对应的是盐酸 |
| B、根据图Ⅱ可知,若除去CuSO4溶液中的Fe3+,可向溶液中加入CuO2调节pH在4-5之间即可 |
| C、图Ⅲ可表示乙酸溶液中通入氨气至过量的过程中溶液导电性的变化 |
| D、图Ⅳ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mLBa(OH)2溶液时,沉淀全部是BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
| B、NaHCO3溶液中:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、pH=2的盐酸溶液与pH=12的氨水混合所得溶液中:cc(H+)+(NH4+)=c(OH-)+c(Cl-) |
| D、等物质的量的CH3COOH和CH3COONa溶液等体积混合所得溶液中:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后的固体混合物中Cu的质量为12.8 g |
| B、反应后的固体混合物中还含有碳 |
| C、反应后的固体混合物总质量为13.6 g |
| D、反应后的固体混合物中氧化物的物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④⑤ | B、③⑤ | C、④⑤ | D、全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com