
| A、稀碳酸钠溶液 | B、硫酸钠溶液 |
| C、稀硫酸 | D、硫酸铜溶液 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
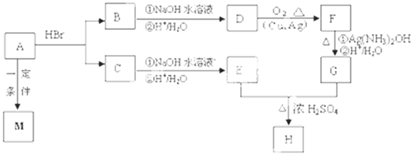
查看答案和解析>>
科目:高中化学 来源: 题型:
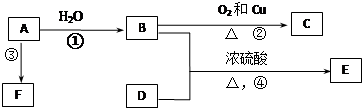 下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题:
下列各有机物转化关系如图,A具有催热水果的作用;D能使石蕊试液变红;E是不溶于水的E是不溶于水且具有香味的无色液体,相对分子质量是C的2倍;F是高分子化合物,常用于制食品包装袋.结合如图关系回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
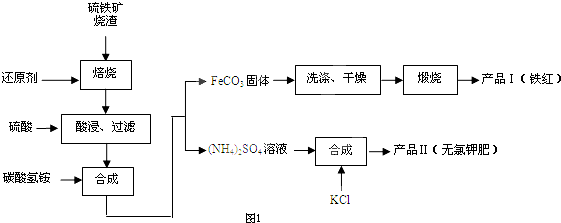
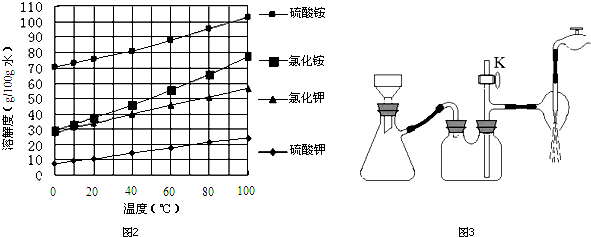
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测定中和热:取25 mL0.25 mol/L的硫酸溶液和25 mL0.5 mol/LNaOH溶液中和,测定反应放出的热 |
| B、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液 |
| C、将SO2与CO2的混合气通过品红溶液洗气后,可除去CO2中的SO2 |
| D、向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,可除去Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
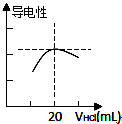 某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理测定某氨水的物质的量浓度,以测量溶液导电性判断滴定终点.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com