
【题目】甲醇是一种重要的化工原料,在化工领域有广泛应用。
(1)甲醇燃料电池由于结构简单、能量转化率高、对环境天污染,可作为常规能源的替代品而越来越受到关注。其工作原理如如图所示:
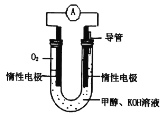
①该电池正极的电极反应为___,放电过程中负极区域溶液的pH值___(填“变大”或“变小”或“不变”)。
②该电池总反应的化学方程式为___。
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高校、光谱、安全的杀菌消毒剂。目前已开发出用电解法制取ClO2的新工艺。
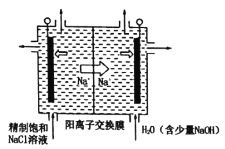
①如图中用石墨作电极,在一定条件下电解饱和食盐水制取ClO2。则阳极产生ClO2的电极反应式为____。
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为___mol。
(3)英国《自然》杂志近期报道了一种新型铝离子电池,以金属铝和石墨为电极,用A1Cl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。
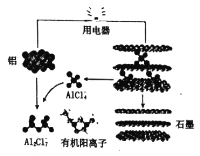
①电池放电时负极的电极反应式为___。
②充电时有机阳离子向___电极移动(填“铝”或“石墨”)。
③电池充电时,电路中每转移0.15mol电子,理论上生成___g铝。
【答案】O2+4e-+2H2O=4OH- 变小 2CH3OH+3O2+4OH-=2CO32-+6H2O Cl--5e-+2H2O=ClO2+4H+ 0.01 Al-3e-+7A1Cl4-=4A12Cl7- 铝 1.35
【解析】
(1)①原电池中的氧气得电子,与溶液中的水反应生成氢氧根离子,作电池的正极;负极上甲醇失电子,与溶液中的氢氧根离子反应生成碳酸根离子和水;
②该电池总反应为甲醇、氧气与溶液中的氢氧根离子反应生成碳酸根离子和水;
(2)①阳极上的氯离子失电子,与溶液中的水反应生成ClO2和氢离子;
②阴极水电离产生的氢离子得电子,生成氢气;
(3)①根据图像可知,放电时,负极的Al失电子与A1Cl4-结合生成A12Cl7-;
②充电时,Al电极为阴极,有机阳离子向阴极移动;
③电池充电时,4A12Cl7-+3e-=Al+7A1Cl4-。
(1)①原电池中的氧气得电子,与溶液中的水反应生成氢氧根离子,作电池的正极,电极反应式为O2+4e-+2H2O=4OH-;负极上甲醇失电子,与溶液中的氢氧根离子反应生成碳酸根离子和水,则pH变小;
②该电池总反应为甲醇、氧气与溶液中的氢氧根离子反应生成碳酸根离子和水,方程式为2CH3OH+3O2+4OH-=2CO32-+6H2O;
(2)①阳极上的氯离子失电子,与溶液中的水反应生成ClO2和氢离子,电极方程式为Cl--5e-+2H2O=ClO2+4H+;
②阴极水电离产生的氢离子得电子,生成氢气,生成标况下的112mL氢气即0.005mol时,转移0.01mol电子,通过阳离子交换膜的阳离子的物质的量为0.01mol;
(3)①根据图像可知,放电时,负极的Al失电子与A1Cl4-结合生成A12Cl7-,则电极反应式为Al-3e-+7A1Cl4-=4A12Cl7-;
②充电时,Al电极为阴极,有机阳离子向阴极移动,即铝电极;
③电池充电时,4A12Cl7-+3e-=Al+7A1Cl4-,转移3mol电子,生成1molAl,则电路中每转移0.15mol电子,生成0.05mol铝,即1.35g。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应:C6H12O6+6O2![]() 6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
A. 该生物燃料电池不可以在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C. 消耗1 mol氧气时转移4 mol e-,H+向负极移动
D. 今后的研究方向是设法提高葡萄糖生物燃料电池的效率,从而使其在将来可以为任何可植入医疗设备提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示。下列溶液中离子浓度关系正确的是
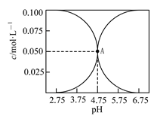
A.c(Na+)=0.1 mol·L-1的溶液中: c(H+)+c(CH3COOH)=c(OH-)
B.点A溶液中:c(Na+)>c(CH3COOH)
C.pH=3.5的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.c(CH3COO-)=0.025 mol·L-1的溶液中:3c(Na+)<c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中进行的可逆反应2NO2![]() 2NO +O2,可作为达到平衡状态的标志是( )
2NO +O2,可作为达到平衡状态的标志是( )
①单位时间内生成amo1O2的同时生成2amolNO2 ;
②单位时间内生成amolO2的同时生成2amolNO;
③混合气体的颜色不再改变;
④混合气体的密度不再改变的状态;
⑤混合气体的平均相对分子质量不再改变的状态;
⑥容器内的压强不再改变。
A.①②③④⑤B.②④⑤⑥C.①③④⑥D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
NH4++NH2—,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是
A.在此温度下液氨的离子积为1×10-17
B.在液氨中放入金属钠,可生成NaNH2
C.恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D.降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体,难溶于CCl4。实验室可将干燥二氧化碳和干燥氨气通入CCl4中进行制备,化学方程式为:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
回答下列问题:
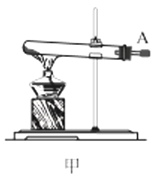
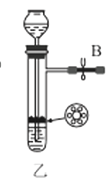

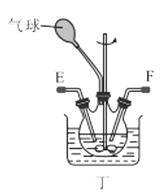
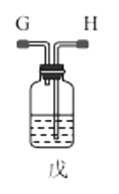
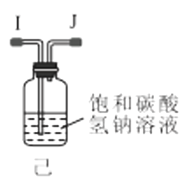
(1)利用装置甲制备氨气的化学方程式为__。
(2)简述检查装置乙气密性的操作__。
(3)选择图中的装置制备氨基甲酸铵,仪器接口的连接顺序为:B→__→__→EF←__←A。
(4)反应时为了增加氨基甲酸铵的产量,三颈瓶的加热方式为__(填“热水浴”或“冷水浴”);丁中气球的作用是__。
(5)从装置丁的混合物中分离出产品的方法是__(填写操作名称)。
(6)取因吸潮变质为碳酸氢铵的氨基甲酸铵样品11.730g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥、称量,质量为15.000g。则样品中氨基甲酸铵的质量分数为__(已知:Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr(CaCO3)=100。计算结果保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国多条高压直流电线路的瓷绝缘子出现铁帽腐蚀现象,在铁帽上加锌环能有效防止铁帽的腐蚀,防护原理如图所示。下列说法错误的是
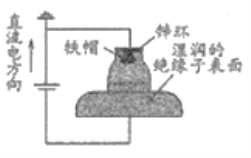
A. 通电时,锌环是阳极,发生氧化反应
B. 通电时,阴极上的电极反应为2H2O+2e-=H2↑+2OH-
C. 断电时,锌环上的电极反应为Zn2++2e-=Zn
D. 断电时,仍能防止铁帽被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com