
【题目】空气阴极祛制备H2O2是一种环境友好型制备方法,装置如图所示,下列说法错误的是
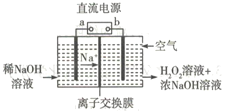
A. b为直流电源的负极
B. 本装置使用的交换膜为阳离子交换膜
C. 通入空气的电极反应式可能为O2+2e-+2H2O=H2O2+2OH-
D. 若生成17g双氧水,则需要通入含11.2 LO2 的空气
科目:高中化学 来源: 题型:
【题目】图中①~③表示的是生物体内3种有机物的分子结构(或局部图)。下列说法正确的是( )

A. ①在层析液中的溶解度比类胡萝卜素大
B. ③失去两个磷酸基团后是组成②的单体之一
C. ①~③存在于所有植物细胞中
D. 含有①的提取液就能通过光反应产生③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是无色有刺激性气味的液体,熔点为-54.1℃,沸点为69℃,在潮湿空气中易“发烟”。实验室利用SO2(g)和Cl2(g)合成硫酰氯的实验装置如下图所示(部分夹持装置已省略):

回答下列问题:
(1)实验室制备干燥纯净的氯气可以用A、B、C装置来完成,请连接装置接口:a→___,____→___,______→f(按气流流动方尚;用小写学母表示)。
(2)实验过程中,使用分液漏斗滴加浓硫酸的操作是_____________。
(3)装置C的作用是____________;装置B和F中浓硫酸起到的作用是①____________;②可观察到____________(填现象)来反映通入气体的速率,利用反应液滴加的快慢对气体通入速率加以控制,从而使通入反应器的SO2和Cl2达到最佳反应比例。
(4)该装置存在明显的缺陷,请指出:________________。
(5)已知该法合成硫酰氯为可逆反应,每生成2.7g硫酰氯放出热量1940J,写出该反应的热化学方程式: ________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 反应A(g) ![]() 2B(g) ΔH,若正反应的活化能为EakJ/mo1,逆反应的活化能为EbkJ/mol,则ΔH=-(Ea-Eb)kJ/mol
2B(g) ΔH,若正反应的活化能为EakJ/mo1,逆反应的活化能为EbkJ/mol,则ΔH=-(Ea-Eb)kJ/mol
B. 将浓度为0.1mol/LHF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,c(F-)/c(H+)始终保持增大
C. 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
D. 0.1mol/L的醋酸的pH=a,0.0lmol/L的醋酸的pH=b,则a+1>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
B.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
C.碳酸氢钠溶液与硫酸氢钠溶液反应:HCO3-+H+=CO2↑+H2O
D.硫酸铝溶液中加入过量氨水: Al3++3OH-=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓
B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌
D.超导材料K3C60
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂、鞣革还原剂、脱氯剂等.它受热、遇酸易分解.它有多种制备方法,其中硫化碱法为:向热的硫化钠和亚硫酸钠混合液中通入二氧化硫,经吸硫、蒸发、结晶,制得硫代硫酸钠晶体.制备过程中发生的主要反应如下: Na2S+H2O+SO2→Na2SO3+H2S …(i)
2H2S+SO2→3S+2H2O …(ii)
S+Na2SO3 ![]() Na2S2O3 …(iii)
Na2S2O3 …(iii)
(1)已知Na2S2O3分解反应是吸热反应,由此可得出:该分解反应中,反应物断裂化学键所吸收的总能量(填“大于”、“小于”或“等于”)生成物形成化学键所放出的总能量.
(2)Na2S2O3具有还原性,判断依据是、(至少写出两条).
(3)上述反应i~iii总反应的化学方程式为 . 制备过程中,即使将反应物的用量按化学方程式的计量数进行配比,反应后各反应物仍有剩余,这说明该过程中存在 .
(4)为了保证硫代硫酸钠的产量,生产中通入的SO2不能过量,原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值.下列有关叙述正确的是( )
A.1 mol D2O分子所含的中子数为8NA
B.48 g氧气和臭氧的混合气体中的氧原子数为3NA
C.11.2 L 甲烷(CH4)中的共价键数为2NA
D.1 mol N2与3 mol H2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知250C时,醋酸溶液中电离平衡常数为k= ×10-5,回答下列问题:
×10-5,回答下列问题:
(1)向溶液中加入少量盐酸,电离平衡______移动,K值________(填“增大” “不变”“减小”)。
(2)若醋酸的起始浓度为0.010mol/L,则平衡时c(H+)=____________________(提示:平衡时的醋酸浓度可近似看为0.010mol/L)。
(3)(2)问中的醋酸电离度为_____________(电离度即醋酸的电离平衡转化率)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com