
【题目】下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是( )
A.半导体材料砷化镓
B.吸氢材料镧镍合金
C.透明陶瓷材料硒化锌
D.超导材料K3C60
科目:高中化学 来源: 题型:
【题目】(1)某温度(t℃)时,水的离子积为KW=1.0×10﹣13mol2L﹣2,则该温度(填“大于”、“小于”或“等于”)_____25℃,其理由是________________________________。
(2)若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计). 若所得混合液为中性,则a:b=_____;此溶液中各种离子的浓度由大到小排列顺序是_________________。
(3)FeCl3的水溶液呈酸性的原因是(用离子方程式表示):______________。
(4)实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以__ (填“促进”、“抑制”)其水解。
(5)把氯化铝溶液蒸干并灼烧固体产物是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2+3B2═2C+D(均为气态物质)的反应来说,以下化学反应速的表示中,反应速率最快的是( )
A.v(A2)=0.4 molL﹣1s﹣1
B.v(D)=6 molL﹣1min﹣1
C.v(C)=0.6 molL﹣1s﹣1
D.v(B2)=0.8 molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《中华人民共和国大气污染防治法》于2016年1月1日起实施。为保护和改善大气环境,下列做法不应该提倡的是
A. 开发生物质能替代化石燃料 B. 向高空排放金属冶炼产生的粉尘
C. 用催化转化技术处理汽车尾气 D. 大力推广生产和使用无氟冰箱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气阴极祛制备H2O2是一种环境友好型制备方法,装置如图所示,下列说法错误的是
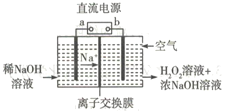
A. b为直流电源的负极
B. 本装置使用的交换膜为阳离子交换膜
C. 通入空气的电极反应式可能为O2+2e-+2H2O=H2O2+2OH-
D. 若生成17g双氧水,则需要通入含11.2 LO2 的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各问题:
(1)①泡沫灭火器中的药品为NaHCO3和Al2(SO4)3,其反应的离子方程式为:__________;
②TiCl4水解生成TiO2·xH2O的化学方程式__________;
③酸性高锰酸钾溶液与草酸溶液反应的化学方程式____________;
④硫代硫酸钠溶液与稀硫酸反应的化学万式____________;
(2)碳酸氢钠溶液中的粒子物质的量浓度有多种关系,请分别写出
①电荷数守恒_________;
②物料守恒___________;
③质子守恒___________;
④下列粒子浓度由大到小的顺序为c(Na+)、c(HCO3-)、c(CO32-),c(H2CO3)、c(OH-)_________。
(3)常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示。所用NaOH溶液浓度为____________。
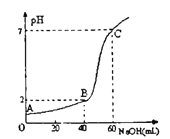
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水,放出572KJ的热量,则表示H2的燃烧热的热化学方程式为_________
(2)如图是某笔记本电脑使用的甲醇燃料电池的结构示意图放电时甲醇应从____处通入(填“a”或“b”).电池内部H+向______(填“左”或“右”)移动。写出电池负极的电极反应式_____。
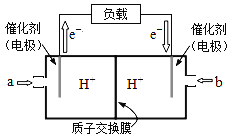
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.已知:N2(g)+3H2(g)=2NH3(g)ΔH=-93kJ/mol,试根据表中所列键能数据计算a的数值__________。
化学键 | H-H | N-H | N≡N |
键能/kJmol | 436 | a | 945 |
当可逆反应中净生成N-H物质的量为2mol时,反应放热________
(4) 已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJmol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJmol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJmol-1
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的△H=___.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1mol·L-1 KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写) 。
(2)上述(B)操作的目的是 。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同) 。
(4)实验中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点。判断到达终点的现象是 。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对测定结果的影响是 。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com