



科目:高中化学 来源: 题型:
A、向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中一定含有S
| ||
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ | ||
| C、将某气体通入品红溶液中,品红溶液褪色,该气体一定是SO2 | ||
| D、将少量某物质的溶液滴加到新制的银氨溶液中,水浴加热后有银镜生成,该物质一定属于醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作① |
| 加试剂A |
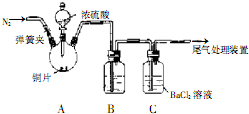
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 | 实验结论 |
Ⅰ.取第一份溶液和适量稀盐酸加入下列装置的试管中,把澄清的石灰水加入烧杯中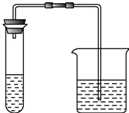 | 清的石灰水变浑浊 | 证明含有碳酸根离子 |
| Ⅱ.取第二份溶液,先别滴加 后加 | 证明含有硫酸根离子 | |
| Ⅲ.取第三份溶液加入过量BaCl2溶液,过滤,除去SO4-和CO32-,再滴加AgNO3溶液和稀硝酸 | 有 | 证明含有氯离子 |
| Ⅳ.取第四份溶液进行焰色反应 | 透过蓝色钴玻璃 火焰呈 | 证明含有K+ |
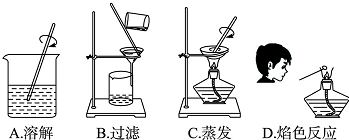
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述实验无法确定是否含有Cl-和NO3- |
| B、溶液中肯定含有CO32-和SO42-,且浓度分别为4.00mol/L、2.00mol/L |
| C、上述实验确定溶液中肯定不含有Mg2+、Fe3+、Al3+ |
| D、要确定是否含有K+,应进一步做焰色反应实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com