
【题目】物质生产工艺的设计,必须牢牢抓住物质的性质,而推断化合物的化学性质,常从两个角度Ⅰ、物质的属类(如氧化物、酸、碱或盐等);Ⅱ、组成元素的化合价(是否处于最高价、中间价态或最低价)。请回答2
(1)已知SiO2是一种难溶于水的酸性氧化物,试写出一个化学方程式表示该物质具有的化学性质:__________________________________;
(2)已知,黄铜矿冶炼铜产生的炉渣含有Fe2O3、FeO、SiO2、Al2O3等多种氧化物,工业生产过程中可利用该炉渣制备Fe2O3。利用炉渣制备氧化铁的生产流程示意图如下:
![]()
①若盐酸浸泡后所得滤液用氯气处理,反应的离子方程式为______________________;经“足量的NaOH溶液”处理后,存在于炉渣中的铝元素最终以_____________形式被除去。
A.Al B.Al(OH)3 C.Al3+ D.[Al(OH)4]—
②现有a、稀硫酸 b、HNO3溶液 c、KSCN溶液 d、KMnO4溶液 e、NaOH溶液 f、碘水等试剂,为检验原炉渣中是否含有FeO,应该选择上述试剂中的_________________(填试剂对应的字母)。若存在FeO,将观察到的现象是________________________。
【答案】 SiO2+2NaOH=Na2SiO3+H2O 2Fe2++Cl2=Fe3++2Cl— D a、d 高锰酸盐颜色褪去
【解析】(1)酸性氧化物能够与碱反应。
(2)①氯气氧化亚铁离子;铝离子与过量的强碱反应生成偏铝酸根子离子。
②炉渣中加入足量的稀盐酸进行溶解,过滤,得到的滤液中再滴加KMnO4溶液,如果溶液褪色,说明溶液中含有亚铁离子。
(1)已知SiO2是一种难溶于水的酸性氧化物,能够与碱反应生成盐和水,反应化学方程式:SiO2+2NaOH=Na2SiO3+H2O;正确答案:SiO2+2NaOH=Na2SiO3+H2O。
(2)①若盐酸浸泡后所得滤液用氯气处理,溶液中的亚铁离子被氧化为铁离子,反应的离子方程式为:2Fe2++Cl2=Fe3++2Cl—;经“足量的NaOH溶液”处理后,铝离子与过量的碱反应生成偏铝酸盐,以[Al(OH)4]—形式存在;正确答案:2Fe2++Cl2=Fe3++2Cl—;D。
②炉渣含有Fe2O3、FeO、SiO2、Al2O3等多种氧化物,加入足量的稀硫酸进行溶解,过滤,得到的滤液中再滴加KMnO4溶液,如果溶液褪色,说明溶液中含有亚铁离子,炉渣中含有FeO;正确答案: a、d; 高锰酸盐颜色褪去。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】从海水中提取溴的工业流程如图:
(1)以上步骤I中已获得游离态的溴,步骤II又将之转变成化合态的溴,其目的是 。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的 。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数及相应物质:
口Br2 + 口CO32-![]() 口BrO3-+ 口Br-+ 口
口BrO3-+ 口Br-+ 口
(4)上述流程中吹出的溴蒸气, 也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏,写出溴与二氧化硫水溶液反应的化学方程式: 。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是 。
A.乙醇 B.四氯化碳 C.烧碱溶液 D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示甲、乙为相互串联的两电解池.试回答: 
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为极,电极材料是 , 电极反应式为 .
(2)乙池中C(石墨)极电极反应式为 , 若在乙池中滴入少量酚酞试液,电解一段时间后,铁极附近呈色.
(3)若甲池A极增重1.28g,则乙池Fe极放出的气体在标况下的体积为 . 电解后,若乙池剩余溶液为400mL,则溶液的pH= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校合作学习小组的同学设计实验验证Na2SO4与焦炭高温加热后的产物。回答下列问题。
(1)Na2SO4与焦炭反应的实验装置如下图所示:
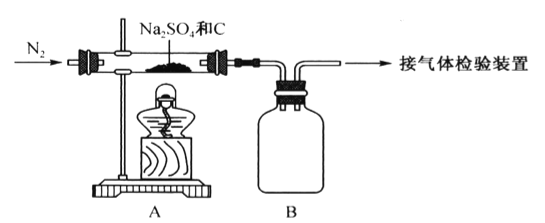
①先通入N2,然后加热,直至反应结束,整个过程中N2的作用是__________________________。
②装置B的作用是___________。
(2)该同学认为气体产物中可能含有CO2、CO 及SO2,并进行验证,选用上述实验中的装置A、B和下图所示的部分装置(可以重复选用)进行实验。
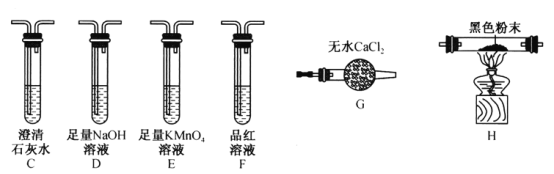
①实验装置连接的合理顺序为A、B、___________。装置H中黑色粉末是___________。
②能证明产物中有CO的现象是____________________________________________。
③若含有SO2,E装置的作用是______________________________(用化学方程式说明)。
(3)某同学利用下图装置验证固态产物,能证明固态产物中含有Na2S的现象是___________。若实验中发现固态产物完全反应后,锥形瓶底部还产生少量黄色沉淀,说明固体产物中除含有Na2S外,还含有少量的___________(填一种可能的物质)。
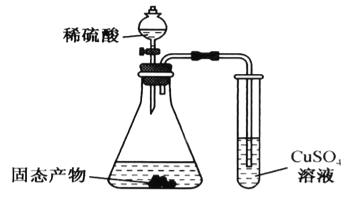
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家利用下图装置成功地实现了CO2和H2O合成CH4,下列叙述错误的是

A. 电池工作时,实现了将太阳能转化为电能
B. 铜电极为正极,电极反应式为CO2+8eˉ+8H+=CH4+2H2O
C. 电池内H+透过质子交换膜从右向左移动
D. 为提高该人工光合系统的工作效率,可向装置中加入少量稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1的H2SO3溶液中滴加0.2mol·L-1 NaOH溶液,含硫微粒的物质的量(n)变化曲线如图所示,下列有关说法正确的是

A. 曲线Ⅱ代表H2SO3的浓度
B. a、b、c三个交点处水的电离程度大小:a<b<c
C. 当V(NaOH)=20mL时,溶液中各离子浓度的大小顺序为:c(Na+)>(HSO3ˉ) >c(SO32-)>c(H+)>c(OHˉ)
D. 若c点pH=6.5,则Ka2(H2SO3)=10-7.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生如下转化:

(1)乙烯的结构简式是________。
(2)乙酸乙酯中的官能团是________。
(3)③的反应类型是________。
(4)②的化学反应方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com