
【题目】已知乙烯能发生如下转化:

(1)乙烯的结构简式是________。
(2)乙酸乙酯中的官能团是________。
(3)③的反应类型是________。
(4)②的化学反应方程式是________。
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】物质生产工艺的设计,必须牢牢抓住物质的性质,而推断化合物的化学性质,常从两个角度Ⅰ、物质的属类(如氧化物、酸、碱或盐等);Ⅱ、组成元素的化合价(是否处于最高价、中间价态或最低价)。请回答2
(1)已知SiO2是一种难溶于水的酸性氧化物,试写出一个化学方程式表示该物质具有的化学性质:__________________________________;
(2)已知,黄铜矿冶炼铜产生的炉渣含有Fe2O3、FeO、SiO2、Al2O3等多种氧化物,工业生产过程中可利用该炉渣制备Fe2O3。利用炉渣制备氧化铁的生产流程示意图如下:
![]()
①若盐酸浸泡后所得滤液用氯气处理,反应的离子方程式为______________________;经“足量的NaOH溶液”处理后,存在于炉渣中的铝元素最终以_____________形式被除去。
A.Al B.Al(OH)3 C.Al3+ D.[Al(OH)4]—
②现有a、稀硫酸 b、HNO3溶液 c、KSCN溶液 d、KMnO4溶液 e、NaOH溶液 f、碘水等试剂,为检验原炉渣中是否含有FeO,应该选择上述试剂中的_________________(填试剂对应的字母)。若存在FeO,将观察到的现象是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,充分燃烧一定量的丁烷放出热量Q kJ(Q>0),经测定完全吸收生成的CO2需消耗5 mol/L的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(g)的ΔH为
A. +8Q kJ/mol B. +16Q kJ/mol
C. -8Q kJ/mol D. -16Q kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( )
A.2 mol
B.3 mol
C.4 mol
D.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2
B.硝酸不稳定,受热或光照易分解
C.铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处
D.Cl2能与金属活动顺序表中大多数金属反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙苯是主要的化工产品。某课题组拟制备乙苯:
查阅资料如下:
①几种有机物的沸点如下表:
有机物 | 苯 | 溴乙烷 | 乙苯 |
沸点/℃ | 80 | 38.4 | 136.2 |
②化学原理: ![]() +CH3CH2Br
+CH3CH2Br![]()
![]() +HBr。
+HBr。
③氯化铝易升华、易潮解。
I.制备氯化铝。
甲同学选择下列装置制备氯化铝(装置不可重复使用):

(1)本实验制备氯气的离子方程式为______________。
(2)气体流程方向是从左至右,装置导管接口连接顺序a→_____→k→i→f→g→_____。
(3)D装置存在的明显缺陷是____;改进之后,进行后续实验。
(4)连接装置之后,检查装置的气密性,装药品。先点燃A处酒精灯,当_____时(填实验现象),点燃F处酒精灯。
II.制备乙苯
乙同学设计实验步骤如下:

步骤1:连接装置并检查气密性(如图所示,夹持装置省略)。
步骤2:用酒精灯微热烧瓶。
步骤3:在烧瓶中加入少量无水氯化铝、适量的苯和溴乙烷。
步骤4:加热,充分反应半小时。
步骤5:提纯产品。
回答下列问题:
(5)步骤2“微热”烧瓶的目的是___________。
(6)本实验加热方式宜采用_______。 (填“ 酒精灯直接加热” 或“水浴加热”)。
(7)盛有蒸馏水的B装置中干燥管的作用是______。确认本实验A中已发生了反应的方法是___。
(8)提纯产品的操作步聚有:①过滤;②用稀盐酸洗除;③少量蒸馏水水洗;④加入大量无水氯化钙;⑤用大量水洗;⑥蔡馏并收集136.2℃馏分。先后操作顺序为__________(填代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体元素的叙述,正确的是
A. 组成细胞的元素中C、H、O、N这四种元素的含量最多.
B. Zn2+是人体中200多种酶的组成成分,说明锌是人体内的大量元素
C. 组成生物体和组成无机自然界的化学元素中.碳元素的含量最多
D. 原核生物细胞内含微量元素,真核生物细胞内不含微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废钢渣和稀硫酸共网作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________。

(2)从辉铜矿中浸取铜元素时,可用FeC13溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为__________。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是__________。
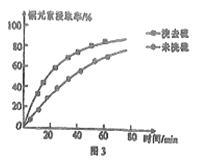
(3)“萃取”时,两种金属离子萃取率与PH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是__________。

(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为__________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_______、干燥、_____等操作可得到Fe2O3产品。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com