
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废钢渣和稀硫酸共网作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________。

(2)从辉铜矿中浸取铜元素时,可用FeC13溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为__________。
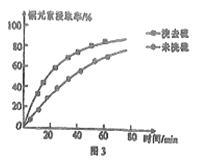
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是__________。
(3)“萃取”时,两种金属离子萃取率与PH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是__________。

(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为__________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_______、干燥、_____等操作可得到Fe2O3产品。
【答案】 CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑ 2mol 4Fe2++O2+4H+=4Fe3++2H2O 生成的硫覆盖在Cu2S表面,阻碍浸取 Fe3+水解程度隨PH的升高而增大 32:7 洗涤 煅烧(或灼烧)
【解析】(1)根据图示,用黄铜矿(主要成分为CuFeS2)、废钢渣和稀硫酸共网作用可获得较纯净的Cu2S,同时生成Fe2+和H2S,反应的离子方程式为:CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑。(2)①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,在反应中,FeCl3中铁元素的化合价由+3降低为+2价,Cu2S中铜元素的化合价由+1升高为+2价,硫元素的化合价由—2升高到0价,化合价升高数=化合价降低数=4,每生成1mol CuCl2转移电子的物质的量为2mol。浸取时,在有氧环境下,亚铁离子被氧化,生成铁离子,反应的方程式为:4Fe2++O2+4H+=4Fe3++2H2O ②浸取过程中,洗涤硫和未洗涤硫相比较, 未洗硫时铜元素浸取率较低原因是生成的硫覆盖在Cu2S表面,阻碍浸取。(3) Fe3+的水解程度随着pH的升高而增大,萃取率越低。 (4)在碱性条件下,Cu2+和N2H4反应生成氮气和铜,反应为:2 Cu2++ N2H4+4OH-=2Cu+N2+4H2O,反应中还原产物是Cu,氧化产物是N2,质量之比为(2×64):28=32:7. (5)萃取后“水相”中含有铁离子,加入氨水反应生成氢氧化铁沉淀,煅烧后可得到氧化铁,方法为:在萃取后的“水相”中加入适量氨水,静置、过滤、洗涤、干燥、煅烧。


科目:高中化学 来源: 题型:
【题目】已知乙烯能发生如下转化:

(1)乙烯的结构简式是________。
(2)乙酸乙酯中的官能团是________。
(3)③的反应类型是________。
(4)②的化学反应方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+O2(g)═2H2O(g)△H=﹣484kJmol﹣1 , 则反应:H2O(g)=H2(g)+1/2O2(g) 的△H为( )
A.─484 kJmol﹣1
B.+484 kJmol﹣1
C.─242 kJmol﹣1
D.+242 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确有几个
①常温常压下,28gC2H4和C4H8的混合物中一定含有6NA个原子
②0℃,101kPa,22.4LCl2通入足量的NaOH溶液充分反应,有2NA个电子转移
③常温下,pH=12的氢氧化钠溶液中OH-数目为0.01NA
④1L1.0mol/LFeCl3溶液全部水解制备氢氧化铁胶体,所得氢氧化铁胶体数目为NA
⑤T℃时,1LpH=6纯水中,含10-6NA个H+
⑥常温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
⑦lmolSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
⑧标准状况下,22.4LHF气体中含有NA个气体分子
⑨用情性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA
A. 3 B. 2 C. 1 D. 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是

A. 常温下,亚硒酸的电离平衡常数K2=10-4.2
B. pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
D. 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某校化学研究性学习小组探究的过量的Fe与浓硫酸反应的实验:
I.甲同学设计如下实验反应得到的混合气体中含有SO2、H2、H2O

己知:CaSO3受热易分解
(1)写出过量Fe粉与浓硫酸反应产生等体积的SO2与H2的总化学方程式:________。
(2)若按气体从左到右的流向,为达到实验目的,各装置连接顺序是A→______(不可重复使用)。
(3)A中导管的作用为______,装置E中的干燥管中盛放的物质为碱石灰,其作用是________。
(4)证明有H2存在的实验现象是_________。
II.为测定混合气体中SO2的体积分数,,乙同学设计了如下实验方案:

(5) W溶液可以是下列溶液中的______(填字母代号);
A.H2O2溶液 B.NaOH溶液 C.KMnO4溶液(硫酸酸化) D.氯水
该混合气体中二氧化硫的体积分数为_______(用含V、m的代数式表示)。
(6)丙同学使用cmol/LxmLI2的淀粉溶液(过量)吸收混合气体,充分反应后,用0.1000mol/L的Na2S2O3标准溶液去滴定I2的淀粉溶液,达到滴定终点时消耗Na2S2O3的体积为20mL,该混合气体中二氧化硫的体积分数为______(用含V、c、x的代数式表示)[已知:I2+2S2O32-=2I-+S4O62-]。
查看答案和解析>>
科目:高中化学 来源: 题型:
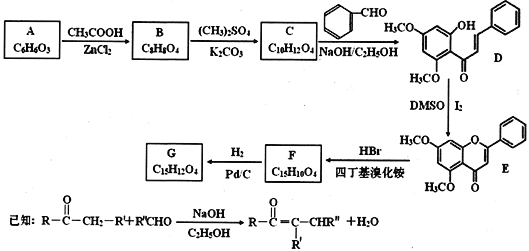
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物。实验室由芳香化合物A制备G的合成路线如下:
回答以下问题:
(1)A中的官能团名称为________________。E的分子式为________________。
(2)由A生成B和由F生成G的反应类型分别是________________、____________。
(3)由C生成D的化学方程式为____________________。
(4)G的结构简式为____________________。
(5)芳香化合物X是B的同分异构体,可与FeCl3溶液发生显色反应,1molX可与4 mol NaOH反应,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3:2:2:1。写出一种符合要求的X的结构简式____________。
(6)写出用环戊烯和正丁醛为原料制备化合物![]() 的合成路线(其他试剂任选):__
的合成路线(其他试剂任选):__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应3A(g)+2B(g)![]() 3C(g)+D(g)达到平衡状态的标志是( )
3C(g)+D(g)达到平衡状态的标志是( )
A. 单位时间内, 生成3mol A, 同时消耗3mol C
B. 单位时间内,生成3mol B,同时消耗2mol A
C. A、B、C、D的分子数之比为3:2:3:1
D. A、B、C、D的浓度保持一定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入N2和H2 , 在一定条件下使反应N2(g)+3H2(g)2NH3(g)△H<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示.下列有关叙述正确的是( ) 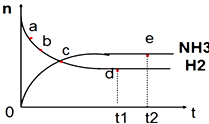
A.c点表示NH3生成速率与NH3分解速率相同
B.c点和e点时反应的平衡常数相同
C.N2的转化率:b>a
D.d点时,n(N2):n(H2):n(NH3)=1:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com