
����Ŀ����֪������(H2SeO3)Ϊ��Ԫ���ᣬ�����£���ijŨ�ȵ���������Һ����μ���һ��Ũ�ȵ�NaOH��Һ��������Һ��H2SeO3��HSeO3-��SeO32-�����������ʵ�����������ҺpH �Ĺ�ϵ��ͼ��ʾ������˵������ȷ����

A. �����£�������ĵ���ƽ�ⳣ��K2=10-4.2
B. pH=l.2����Һ�У�c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. ����ͬ���ʵ���NaHSeO3��Na2SeO3 ������ȫ����ˮ�����pHΪ4.2�Ļ��Һ
D. ��pH=1.2����Һ�еμ�NaOH��Һ��pH=4.2�Ĺ�����ˮ�ĵ���̶�һֱ����
���𰸡�C
��������A:���ݵ��뷴Ӧ����ʽ��H2SeO3=H++HSeO3-��HSeO3-= H++ SeO32-֪K2=c(H+).c(SeO32-) /c(HSeO3-),��PH=4.2ʱ���ﵽƽ�����ԡ���ʱc(HSeO3-)=c(SeO32-)
˵��K2=10-4.2��A��ȷ��B.pH=l.2����Һ��H2SeO3��HSeO3-��Ũ����ȣ����ݵ���غ��ϵ֪��c(Na+)+c(H+)=c(OH-)+c(H2SeO3)����ȷ�ģ���B�ԣ�C.����ͬ���ʵ���NaHSeO3��Na2SeO3 ������ȫ����ˮ�������pHΪ4.2�Ļ��Һ��Na2SeO3ǿ�������Σ�ˮ���Լ��ԣ�NaHSeO3ˮ��ﵽƽ��ʱPH=4.2��������������PHһ������4,2.��C����D.��pH=12����Һ�еμ�NaOH��Һ��pH=4.2�Ĺ�������Ϊ�к�����Һ�е������ӣ��ٽ���ˮ�ĵ��룬��ˮ�ĵ���̶�һֱ����D��ȷ��


 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���� (����)
A.N2�Ǵ����е���Ҫ�ɷ�֮һ������ʱ����ֱ��ת��ΪNO2
B.����ȶ������Ȼ�����ֽ�
C.��������ֽ⣬��������̬����ʱҪ�ܷⱣ�棬����������ͨ�紦
D.Cl2��������˳����д����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z ���ǽ������� X ���� Z ����������Һ�У�X �ı����� Z ������X �� Y ���ԭ���ʱ��Y Ϊ��صĸ�����X��Y��Z ���ֽ����Ļ��˳��Ϊ( )
A.X>Y>ZB.X>Z>YC.Y>X>ZD.Y>Z>X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����һѡ��5���л���ѧ����]�л���M�п������ã���ϳ�·������ͼ��ʾ
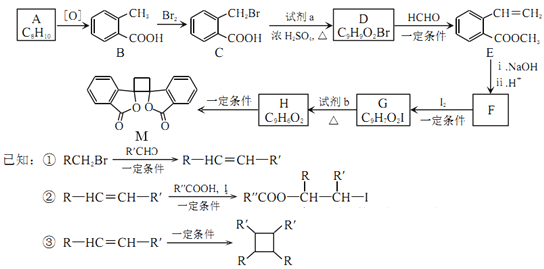
(1)A�Ľṹ��ʽ��______________��
(2)B��������____________��M�еĹ�����������_____________��
(3)�ֱ�д��B��C��G��H�ķ�Ӧ����___________��_____________��
(4)д��}C��D�Ļ�ѧ����ʽ_________________________________��
(5)E��ͬ���칹���У��������������Ľṹ����_______�֡�
�ٱ��Ķ�Ԫȡ���� ����E������ͬ�Ĺ����� ���ܷ���������Ӧ��ˮ�ⷴӦ
(6)��F��I2��һ�������·�Ӧ����G�Ļ�ѧ����ʽ��____________________���˷�Ӧͬʱ��������һ���л�����������F��Ϊͬ���칹�壬���л�������Ľṹ��ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���M(����ʽ��C6H4S4)�����ηɻ����������ϵ���Ҫ�ɷ֡�ij��ѧ��ȤС��Ϊ��֤�����Ԫ�أ���̽������ӽṹ����������ʵ�飺
(1)��֤���Ԫ��
��������Ʒ����ȼ�չ�A�У�ͨ������O2���õ�¯����ʹ����ȼ�գ�����ȼ�ղ�������ͨ������װ�á�(�г�������װ������ȥ)
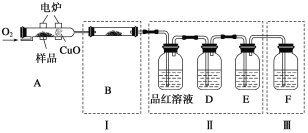
��д��A����Ʒȼ�յĻ�ѧ����ʽ��_____________________________________��
��װ��B��Ŀ������֤�л����к���Ԫ�أ���B��ʢװ���Լ�Ϊ________________��
��D��ʢ�ŵ��Լ���_________________(�����)��
a��NaOH��Һ�� b��Ʒ����Һ�� c������KMnO4��Һ d.����ʯ��ˮ
����֤���л��ﺬ̼Ԫ�ص�������_________________��
��װ�â��ܻ�����������___________________��
��ȼ�չ��з���CuO��������_______________________��
��ָ��װ��F�Ĵ���____________________________��
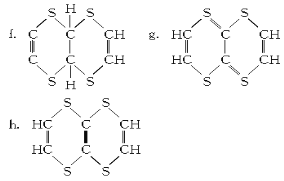
(2)̽���л���M�ķ��ӽṹ�߶ȶԳƣ���ԭ�ӵĻ�������ͬ����2.04 g���л���������CCl4��Һ���������Һ��ɫ����������0.03 mol Br2��
����л�����ӽṹ�к��еĹ�����Ϊ___________________(��ṹʽ)��
���л���M�Ľṹ��ʽΪ_________________(�����)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͭ��һ����������ij�������,�Ի�ͭ��(��Ҫ�ɷ�ΪCu2S)Ϊԭ���Ʊ�����ͭ�۵Ĺ���������ͼ1��ʾ��

(1)�û�ͭ��(��Ҫ�ɷ�ΪCuFeS2)���ϸ�����ϡ���Ṳ�����ÿɻ�ýϴ�����Cu2S,��ԭ����ͼ2��ʾ���÷�Ӧ�����ӷ���ʽΪ__________��

(2)�ӻ�ͭ���н�ȡͭԪ��ʱ������FeC13��Һ����ȡ����
�ٷ�Ӧ:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,ÿ����1molCuCl2,��Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ____;��ȡʱ�������������¿�ά��Fe3+�ϸ�Ũ�ȣ��йط�Ӧ�����ӷ���ʽΪ__________��
�ڽ�ȡ�����м���ϴ�Ӽ��ܽ���ʱ��ͭԪ�ؽ�ȡ�ʵı仯��ͼ3��ʾ��δϴ��ʱͭԪ�ؽ�ȡ�ʽϵͣ���ԭ����__________��
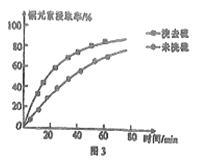
(3)����ȡ��ʱ�����ֽ���������ȡ����PH�Ĺ�ϵ��ͼ4��ʾ����pH>1.7ʱ��pHԽ����������ȡ��Խ�ͣ�����Fe3+��ȡ�ʽ��͵�ԭ����__________��

(4)�á�����ȡ���õ���CuSO4��Һ�Ʊ�����ͭ��ʱ���÷�Ӧ�л�ԭ�������������������֮��Ϊ__________��
(5)����ȡ��ġ�ˮ�ࡱ�м���������ˮ�����ã��پ����ˡ�_______�����_____�Ȳ����ɵõ�Fe2O3��Ʒ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʵ���Ũ����ͬ�ģ��ٰ�ˮ ���Ȼ�� ��̼����� ��������� �������������Һ��C��NH ![]() ���ɴ�С��˳����������ţ���
���ɴ�С��˳����������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2A��g��+2B��g��C��g��+3D��g�� �ڲ�ͬ����²������4�ַ�Ӧ���ʣ����з�Ӧ�����ǣ�������
A.v��A��=0.45mol/��Ls��
B.v��B��=0.6mol/��Ls��
C.v��C��=0.5mol/��Lmin��
D.v��D��=0.4mol/��Ls��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ��ǣ������� 
A.ͼ�ٱ�ʾ25��ʱ����0.1 mol/L����ζ�20 mL 0.1 mol/L NaOH��Һ����Һ��pH�����������ı仯
B.ͼ�������߱�ʾ��Ӧ2SO2��g��+O2��g��2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C.ͼ�۱�ʾ10 mL 0.01 mol/L KMnO4������Һ�������0.1 mol/L H2C2O4��Һ���ʱ��n��Mn2+����ʱ��ı仯
D.ͼ����a��b���߷ֱ��ʾ��Ӧ��CH2�TCH2��g��+H2��g����CH3CH3��g����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е��������仯
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com