
【题目】物质的量浓度相同的:①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵五种溶液中C(NH ![]() )由大到小的顺序是(填序号).
)由大到小的顺序是(填序号).
【答案】⑤>④>②>③>①
【解析】解:可分3种情况讨论:(1)氨水电离产生NH4+、OH﹣,一水合氨电离程度很小;(2)NH4+水解产生H+及剩余NH4+;(3)NH4+水解受到影响,促进或抑制;在分析时要注意两点:氨水电离程度较小,NH4+水解程度也较小;另外,NH4HSO4溶液中,H+抑制NH4+水解,而NH4HCO3中,HCO3﹣比氨水更弱,HCO3﹣水解呈碱性,会促进NH4+水解,(NH4)2SO4中含有2个铵根离子,所以(NH4)2SO4中NH4+的浓度最大;所以,NH4+的浓度由大到小顺序为(NH4)2SO4、NH4HSO4、NH4Cl、NH4HCO3、NH3H2O,
所以答案是:⑤>④>②>③>①.
【考点精析】认真审题,首先需要了解弱电解质在水溶液中的电离平衡(当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理).


科目:高中化学 来源: 题型:
【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
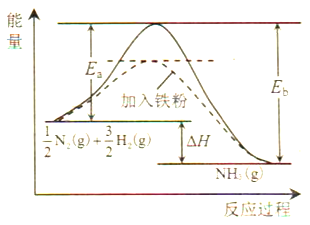
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO
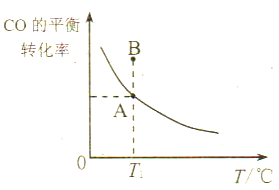
①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法不正确的是

A. 常温下,亚硒酸的电离平衡常数K2=10-4.2
B. pH=l.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C. 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
D. 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项关于铜电极的叙述正确的是( )
A. 铜锌原电池中铜是负极
B. 用电解法精炼粗铜时粗铜作阴极
C. 在镀件上镀铜时可用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种具有多种药理学活性的黄烷酮类药物。实验室由芳香化合物A制备G的合成路线如下:
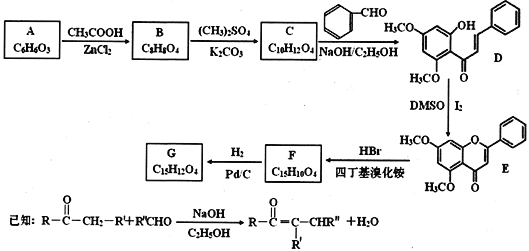
回答以下问题:
(1)A中的官能团名称为________________。E的分子式为________________。
(2)由A生成B和由F生成G的反应类型分别是________________、____________。
(3)由C生成D的化学方程式为____________________。
(4)G的结构简式为____________________。
(5)芳香化合物X是B的同分异构体,可与FeCl3溶液发生显色反应,1molX可与4 mol NaOH反应,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3:2:2:1。写出一种符合要求的X的结构简式____________。
(6)写出用环戊烯和正丁醛为原料制备化合物![]() 的合成路线(其他试剂任选):__
的合成路线(其他试剂任选):__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下进行反应:mA(g)+nB(g)pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )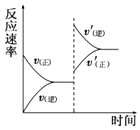
A.正反应是吸热反应,m+n>p+q
B.逆反应是吸热反应,m+n<p+q
C.正反应是吸热反应,m+n<p+q
D.逆反应是吸热反应,m+n>p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
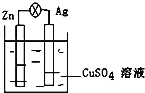
【题目】在银锌原电池中,以硫酸铜为电解质溶液,锌为_____极,电极上发生的是_____反应(“氧化”或“还原”).电极反应式为_____,锌片上观察到的现象为_____银为_____极,电极上发生的是_____反应(“氧化”或“还原”),电极反应式是_____,银片上观察到的现象是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B两种液态有机物均由碳、氢、氧三种元素组成。A能溶于水,它的相对分子质量是60,分子中有8个原子,其中氧原子数与碳原子数相等,且A与碳酸钠溶液混合时冒气泡。B分子中有9个原子,分子内所有原子的核电荷数之和为26,且B只能跟钠反应放出氢气,不能与碳酸钠溶液反应。
(1)A的结构简式为 __________________ ,B的结构简式为 ________________。
(2)写出A与碳酸钠溶液反应的化学方程式________________________________。
(3)写出B与钠反应的化学方程式_____________________________。
(4)写出A与B反应的化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com