
【题目】为了改善环境,科学家投入了大量的精力研究碳、氮及其化合物的转化。请回答下列有关问题:
(1)利用N2与H2合成氨是重要的工业反应,下图为反应过程中的能量变化关系。
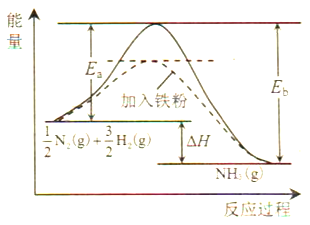
①反应中加入铁粉可以提高反应速率,其原因是____________。
②已知某些化学键键能数据如下表:
化学键 | H-H | N≡N | N-H |
E/(kJ/mol) | 436 | 946 | 391 |
反应![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)
NH3(g)的活化能Ea=254kJ/mol,则反应NH3(g)![]()
![]() N2(g)+
N2(g)+![]() H2(g)的活化能Eb=______kJ/mol。
H2(g)的活化能Eb=______kJ/mol。
(2)汽车内燃机工作时会将N2转化为NO,反应式为N2(g)+O2(g) ![]() 2NO(g),该反应在不同温度下的平衡常数K如下表:
2NO(g),该反应在不同温度下的平衡常数K如下表:
温度 | 27℃ | 2000℃ |
K | 3.8×10-31 | 0.1 |
温度为2000℃,某时刻测得反应体系中各物质的浓度分别为c(N2)=0.2mol/L,c(O2)=0.03mol/L,c(NO)=0.03mol/L,此时该反应的速率(v)应满足的关系为_______(填字母序号)。
A.v正>v逆 B.v正=v逆 C.v正<v逆 D.无法确定
(3)工业上可将CO转化成甲醇,反应式为:CO(g)+2H2(g)![]() CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO
CH3OH(g)。若在一容积可变的密闭容器中充入1molCO和2molH2进行反应,初始体积为3L,保持压强不变,反应后CO
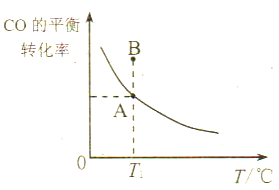
①若所加的CO和H2的量以及反应温度均不变,则达到平衡状态A、B时的压强pA____pB(填“>”、“<”或“=”),其原因是___________________。
②若达到化学平衡状态A时,CO的体积分数为25%,此时CO的转化率为_____;平衡常数KA=________。
【答案】 降低了合成氨反应的活化能 300 C < 该反应为气体分子数减小的反应,增大压强,有利于平衡向正向移动。CO转化率升高,故pA<pB 50% 4L2/mol2
【解析】(1)①通过图像可出铁粉作催化剂,降低了合成氨反应的活化能,提高了反应速率;正确答案:降低了合成氨反应的活化能。
②针对反应![]() N2(g)+
N2(g)+ ![]() H2(g)
H2(g) ![]() NH3(g),反应热=反应物断键吸收的总能量-生成物成键放出的总能量=436×1.5+946×0.5-3×391=-46 kJ·mol-1;反应热=Ea-Eb=-46,254-Eb=-46,Eb=300 kJ·mol-1,所以反应NH3(g)
NH3(g),反应热=反应物断键吸收的总能量-生成物成键放出的总能量=436×1.5+946×0.5-3×391=-46 kJ·mol-1;反应热=Ea-Eb=-46,254-Eb=-46,Eb=300 kJ·mol-1,所以反应NH3(g) ![]()
![]() N2(g) +
N2(g) + ![]() H2(g) 的活化能Eb=300 kJ·mol-1;正确答案:300。
H2(g) 的活化能Eb=300 kJ·mol-1;正确答案:300。
(2) 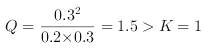 ,平衡逆向移动,v(正)
,平衡逆向移动,v(正)![]() (逆),正确答案:C。
(逆),正确答案:C。
(3) ①该反应为气体分子数减小的反应,增大压强,平衡右移,CO转化率升高,所以根据图像可知:PA小于pB;正确答案:< ;该反应为气体分子数减小的反应,增大压强,有利于平衡向正向移动。
② 设一氧化碳的变化量为X mol;
CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
起始量 1 2 0
变化量 X 2X X
平衡量 1-X 2-2X X
若达到化学平衡状态A时,CO的体积分数为25%,(1-X)/(1-X+2-2X+X)= 0.25,X=0.5mol, 此时CO的转化率为0.5/1×100%=50%;根据气体的总量和体积成正比规律:反应前混合气体为3mol,体积为3L,反应后混合气体为2 mol,体积为2L,平衡后各物质浓度为c(CH3OH)=0.5/2=0.25mol/L, c(CO)=0.5/2=0.2mol/L, c(H2)=1/2=0.5mol/L,平衡常数KA=c(CH3OH)/c(CO)c2(H2)=0.25/0.25×(0.5)2= 4L2/mol2;正确答案:50%; 4L2/mol2。


科目:高中化学 来源: 题型:
【题目】已知反应A+3B=2C+D在某段时间内以A的浓度变化表示的化学反应速率为2 mol·L-1·s-1,则此段时间内用B的浓度变化表示的化学反应速率为( )。
A.5 mol·L-1·s-1 B.6 mol·L-1·s-1 C.2 mol·L-1·s-1 D.3 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料或用于制作微型激光器或太阳能电池的材料等。部分元素在周期表中位置如下:
A1 | Si | P |
Ga | Ge | As |
回答下列问题:
(1)六种元素中,非金属性最强的元素是:________.写出As原子的最外层的电子排布式_________,As原子核外有_____个未成对电子。
(2)根据元素周期律,可判断原子半径Ga_____As。(选填“>”、“<”或“=”)。写出铝的最高价氧化物对应水化物的电离方程式:________________
(3)NH3的分子构型是_______。GaF3的熔点高于1000°C,GaCl3的熔点为77.9°C,可能的原因是_______.写出C2H2的电子式为:_________
(4)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因___________
GeCl4 | GeBr4 | GeI4 | |
熔点/°C | -49.5 | 26 | 146 |
沸点/°C | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 都是金属,把 X 浸入 Z 的硝酸盐溶液中,X 的表面有 Z 析出,X 和 Y 组成原电池时,Y 为电池的负极。X、Y、Z 三种金属的活动性顺序为( )
A.X>Y>ZB.X>Z>YC.Y>X>ZD.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+ B2= 2AB的能量变化如图所示,则下列说法正确的是( )

A. 该反应是吸热反应
B. 断裂1 mol A—A键和1 mol B—B键能放出x kJ的能量
C. 断裂2 mol A—B键需要吸收y kJ的能量
D. 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——一选修5:有机化学基础]有机物M有抗菌作用,其合成路线如下图所示
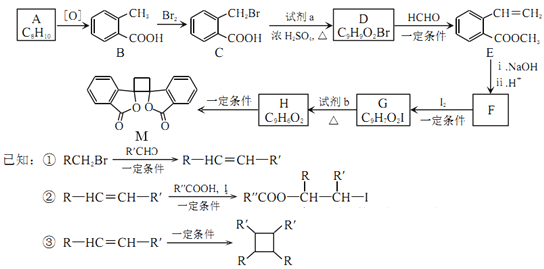
(1)A的结构简式是______________。
(2)B的名称是____________,M中的官能团名称是_____________。
(3)分别写出B→C、G→H的反应类型___________、_____________。
(4)写出}C→D的化学方程式_________________________________。
(5)E的同分异构体中,符合下列条件的结构共有_______种。
①苯的二元取代物 ②与E具有相同的官能团 ③能发生银镜反应和水解反应
(6)由F与I2在一定条件下反应生成G的化学方程式是____________________;此反应同时生成力外一个有机副产物且与F互为同分异构体,此有机副产物的结构简式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M(分子式:C6H4S4)是隐形飞机上吸波材料的主要成分。某化学兴趣小组为验证其组成元素,并探究其分子结构进行了下列实验:
(1)验证组成元素
将少量样品放入燃烧管A中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置。(夹持仪器的装置已略去)
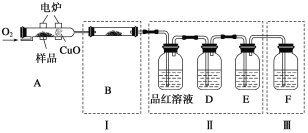
①写出A中样品燃烧的化学方程式:_____________________________________。
②装置B的目的是验证有机物中含氢元素,则B中盛装的试剂为________________。
③D中盛放的试剂是_________________(填序号)。
a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.饱和石灰水
④能证明有机物含碳元素的现象是_________________。
⑤装置Ⅰ、Ⅱ不能互换的理由是___________________。
⑥燃烧管中放入CuO的作用是_______________________。
⑦指出装置F的错误____________________________。
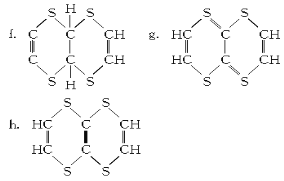
(2)探究有机物M的分子结构高度对称,氢原子的环境都相同。将2.04 g该有机物加入溴的CCl4溶液,充分振荡后溶液褪色,并消耗了0.03 mol Br2。
⑧该有机物分子结构中含有的官能团为___________________(填结构式)。
⑨有机物M的结构简式为_________________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】组成RXA分子结构的基本成分是
①核糖 ②脱氧核糖 ③磷酸 ④腺嘌呤、鸟嘌呤、胞嘧啶 ⑤胸腺嘧啶 ⑥尿嘧啶
A. ①③④⑤ B. ①②⑥ C. ②③④⑤ D. ①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com