
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.43 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高或最低化合价 | +2 | +3 | +5 | +7 | +1 | +5 | |
| -2 | -3 | -1 | -3 |
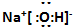 ,属离子化合物,氢氧化钠与氯气反应的化学方程式是2NaOH+Cl2=NaCl+NaClO+2H2O,故答案为:
,属离子化合物,氢氧化钠与氯气反应的化学方程式是2NaOH+Cl2=NaCl+NaClO+2H2O,故答案为: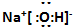 ;离子;2NaOH+Cl2=NaCl+NaClO+2H2O;
;离子;2NaOH+Cl2=NaCl+NaClO+2H2O;

科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应较高温度下不容易自发进行,在低温下容易自发进行 |
| B、增大压强,X、Y、Z浓度均增大,正、逆反应速率均加快 |
| C、升高温度,反应活化能降低,反应速率加快 |
| D、其他条件不变,增大反应物浓度,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
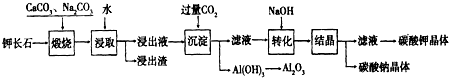
查看答案和解析>>
科目:高中化学 来源: 题型:
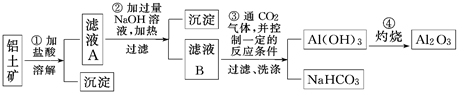
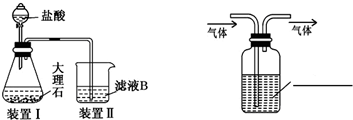
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
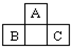 如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:
如图为短周期一部分.A、C两元素原子核外分别有两个、一个未成对电子.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com