
| A、该反应较高温度下不容易自发进行,在低温下容易自发进行 |
| B、增大压强,X、Y、Z浓度均增大,正、逆反应速率均加快 |
| C、升高温度,反应活化能降低,反应速率加快 |
| D、其他条件不变,增大反应物浓度,平衡常数增大 |


科目:高中化学 来源: 题型:
| A、将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:2Al3++7OH?=Al(OH)3↓+AlO2?+2H2O |
| B、醋酸溶液与水垢中的CaCO3反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、少量二氧化硫通入次氯酸钠溶液:SO2+2ClO-+H2O=SO32-+2HClO |
| D、硫化亚铁加入稀硫酸:FeS+2H+=H2S↑+Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 .已知:
.已知: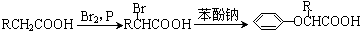
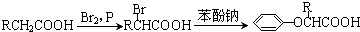

查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.43 | 1.10 | 0.99 | 1.86 | 0.75 |
| 最高或最低化合价 | +2 | +3 | +5 | +7 | +1 | +5 | |
| -2 | -3 | -1 | -3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
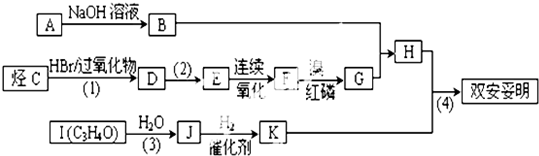
查看答案和解析>>
科目:高中化学 来源: 题型:
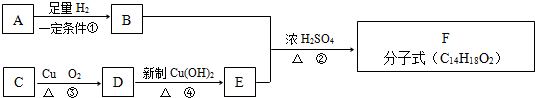
查看答案和解析>>
科目:高中化学 来源: 题型:

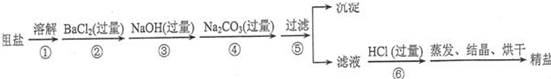
查看答案和解析>>
科目:高中化学 来源: 题型:

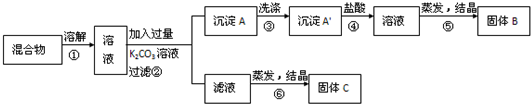
| A、甲为CO2;乙为NH3 |
| B、由滤液提纯(NH4)2SO4过程中的实验操作为萃取 |
| C、CO2可被循环使用 |
| D、上述过程中涉及到的反应全部是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com