

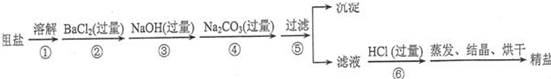
| ||
| ||


科目:高中化学 来源: 题型:
| A、分解反应 | B、置换反应 |
| C、复分解反应 | D、化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应较高温度下不容易自发进行,在低温下容易自发进行 |
| B、增大压强,X、Y、Z浓度均增大,正、逆反应速率均加快 |
| C、升高温度,反应活化能降低,反应速率加快 |
| D、其他条件不变,增大反应物浓度,平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A、表中第①组反应的氧化产物中一定有FeCl3 |
| B、氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ |
| C、还原性比较:H2O2>Mn2+>Cl- |
| D、④的离子方程式配平后,H+的化学计量数为16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
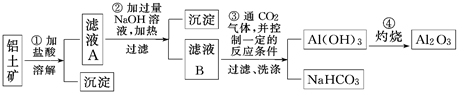
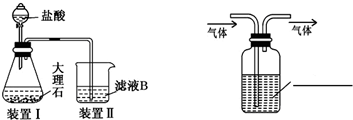
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
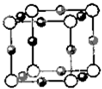 已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、反应A+B
| ||||
| B、相同温度下,与同浓度盐酸反应的锌粉和铁粉产生氢气的速率 | ||||
| C、相同温度下,颗粒大小相同的生铁分别在水和饱和食盐水中的腐蚀生锈 | ||||
| D、一定温度下,相同氢离子浓度、相同体积的盐酸与硫酸分别与大小相同的锌片反应,产生气泡的快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
| 沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1配制250 mL 0.10 mol?L-1盐酸 |
| B、图2稀释浓硫酸 |
| C、图3称量氯化钠固体 |
| D、图4检验铁粉与水蒸气反应产生的氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com