
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:

①该电池放电时正极的电极反应式为_______________________________________;若维持电流强度为1 A,电池工作十分钟,理论上消耗Zn______ g(计算结果保留一位小数,已知F=96500 C·mol-1)。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
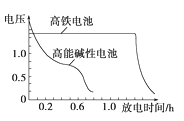
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有__________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__________________________,A是________。

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON (固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为__________________________。

【答案】FeO42—+4H2O+3e-=Fe(OH)3↓+5OH-0.2右左使用时间长、工作电压稳定N2+8H++6e-=2NH4+氯化铵(或NH4Cl)从b到aCO+O2--2e-=CO2
【解析】
(1) ①根据电池装置,锌做负极,碳为正极,高铁酸钾的氧化性很强,正极上高铁酸钾发生还原反应生成氢氧化铁,电极反应为 FeO42—+4H2O+3e-=Fe(OH)3↓+5OH-;若维持电离强度为1A,电池工作十分钟,通过的电子为![]() ,则理论消耗锌的质量为
,则理论消耗锌的质量为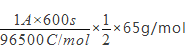 = 0.2g。②盐桥中阴离子向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷、构成闭合回路的作用,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动。③由图可知高铁电池的优点有使用时间长、工作电压稳定。 (2)该电池的本质反应是合成氨的反应,电池中氢气失去电子,在负极上发生氧化反应,氮气得到电子在正极上发生还原反应,则正极反应为N2+8H++6e-=2NH4+,氨气和氯化氢反应生成氯化铵,则电解质溶液为氯化铵。(3)根据图可知,一氧化碳和空气形成燃料电池,一氧化碳失去电子和氧离子反应生成二氧化碳发生氧化反应,电极反应式为CO+O2--2e-=CO2,所以一氧化碳所在极为负极,通入空气的一极为正极,原电池放电时电子从负极流向正极,阴离子向负极移动,所以工作时氧离子的移动方向为从b到a。
= 0.2g。②盐桥中阴离子向负极移动,盐桥起的作用是使两个半电池连成一个通路,使两溶液保持电中性,起到平衡电荷、构成闭合回路的作用,放电时盐桥中氯离子向右移动,用某种高分子材料制成阳离子交换膜代替盐桥,则钾离子向左移动。③由图可知高铁电池的优点有使用时间长、工作电压稳定。 (2)该电池的本质反应是合成氨的反应,电池中氢气失去电子,在负极上发生氧化反应,氮气得到电子在正极上发生还原反应,则正极反应为N2+8H++6e-=2NH4+,氨气和氯化氢反应生成氯化铵,则电解质溶液为氯化铵。(3)根据图可知,一氧化碳和空气形成燃料电池,一氧化碳失去电子和氧离子反应生成二氧化碳发生氧化反应,电极反应式为CO+O2--2e-=CO2,所以一氧化碳所在极为负极,通入空气的一极为正极,原电池放电时电子从负极流向正极,阴离子向负极移动,所以工作时氧离子的移动方向为从b到a。


科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取 50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH 溶液,并用另一温度计测出其温度;③将 NaOH 溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
回答下列问题:
(1)倒入 NaOH 溶液的正确操作是_____(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与 NaOH 溶液混合均匀的正确操作是_____(填序号)。
A.用温度计小心搅拌 B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和 1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为 ΔH1、ΔH2、ΔH3,则 ΔH1、ΔH2、ΔH3 的大小关系为______________________。
(4)假设盐酸和氢氧化钠溶液的密度都是 1 g·cm-3,又知中和反应后生成溶液的比热容 c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度 t1/ ℃ | 终止温度 t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热 ΔH=_____(结果保留一位小数)。_____(填“能”或“不能”)用 Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆 AB 两端分别挂有体积相同.质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入 M 的浓溶液,一段时间后, 下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)( )
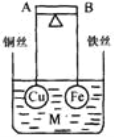
A. 当 M为盐酸、杠杆为导体时,A 端高,B 端低
B. 当 M为 AgNO3、杠杆为导体时,A 端高,B 端低
C. 当 M为 CuSO4、杠杆为导体时,A 端低,B 端高
D. 当 M为 CuSO4、杠杆为绝缘体时,A 端低,B 端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )

A. 反应CH4+H2O![]() 3H2+CO,每消耗1molCH4转移12mol 电子
3H2+CO,每消耗1molCH4转移12mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是________(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________。

(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH=+180kJ/mol。NO分子中化学键的键能为__________________kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:________________。
(5)已知Na2SO4·10H2O![]() Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将________能转化为________能,晚上将________能转化为________能。
Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将________能转化为________能,晚上将________能转化为________能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)X是短周期中原子半径最小的元素,X、Y组成的气体甲能使湿润的红色石蕊试纸变蓝;
①Y的原子结构示意图是______________,甲的空间构型为__________。
②写出向硝酸铝溶液中通入过量气体甲的反应的离子方程式_________________。
(2)用硝酸铝溶液(加入分散剂)制备纳米氧化铝粉体的一种工艺流程如下。
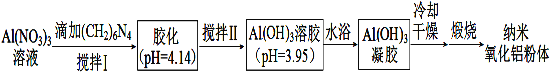
已知:①(CH2)6N4水溶液显碱性。
②Ksp[Al(OH)3] =1.3×10-33 ;溶液中离子浓度小于1×10-5 mol·L-1时,可认为这种离子在溶液中不存在。
凝胶中含有的硝酸盐除硝酸铝外还有___________________(填物质名称)。
(3)“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。某含铝“拟晶” 的化学式为:Al65Cu23Fe12, 它是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能。下列有关这种拟晶的说法正确的是_______________。(填标号)
A.无法确定Al65Cu23Fe12中三种金属的化合价
B.Al65Cu23Fe12的硬度小于金属铁
C.Al65Cu23Fe12不可用作长期浸泡在海水中的材料
D.1 mol Al65Cu23Fe12溶于过量的硝酸时共失去265 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解饱和食盐水是氯碱工业基础。
(1)写出电解饱和氯化钠溶液时的总的离子反应方程式:________________________________________。
(2)当阴极产生1molH2时,通过阳离子交换膜的Na+有_________mol;
(3)产生的氯气可用于制TiCl4,但TiO2与Cl2难以直接反应,加碳生成CO、CO2可使反应得以进行。回答:
已知:TiO2(s) +2Cl2(g)=TiCl4(g)+O2(g) △H1=+175.4kJmol﹣1
2C(s) + O2(g)=2CO(g) △H2=﹣220.9kJmol﹣1
①TiO2与Cl2难以直接反应的原因是__________________________________________
②加碳生成CO、CO2后得以进行原因是________________________________________________________
(4)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
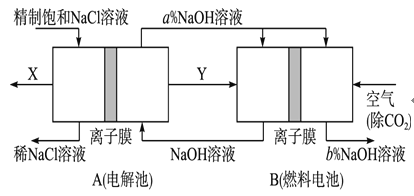
①图中Y是________ (填化学式);
②写出燃料电池B中负极上发生的电极反应:______________________________________________
③比较图示中氢氧化钠溶液质量分数的大小:a%_______b%(填>、=或<)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com