
| A、5g | B、4g | C、8g | D、10g |
| 2.8L |
| 22.4L/mol |
| 65g×0.125mol |
| 1mol |
| 54g×0.125mol |
| 3mol |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
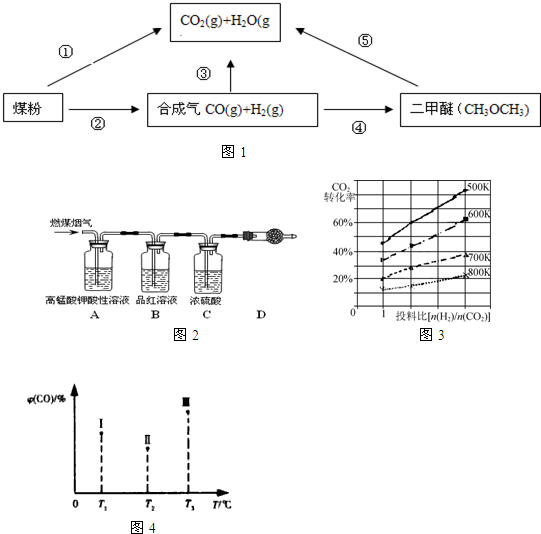
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时A的转化率为90% |
| B、若要使达到平衡时的各气体的物质的量与题目的平衡相同,可充入2mol C和2mol D |
| C、在相同条件下,按2:1充入A和B,平衡时容器体积为210L,则充入A的物质的量为3mol |
| D、相同条件下,若充入4mol C和2mol D,达平衡时放出能量1.8QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |
| 实验步骤 | 现象 |
| 步骤1:取适量的固体产物于试管中,加入足量1.0mol?L-1的盐酸,充分振荡使固体完全溶解 | 固体溶解,没有观察到气泡,溶液呈黄色 |
| 步骤2:取少量步骤1所得溶液于试管中,加入适量20%的KSCN溶液,振荡 | 溶液呈血红色 |
| 步骤3:另取少量步骤1所得溶液于试管中,滴入少量1.0mol?L-1的KMnO4溶液,振荡 | KMnO4的紫红色不褪去 |
| 实验操作 | 预期现象与结论 |
| 步骤1:将少量气体产物通入盛有适量品红溶液的试管中,观察溶液的颜色变化,然后加热再观察溶液的颜色变化 | ①若 ②若 |
步骤2:将气体产物缓缓通过浸在冰水中的U形管(如图),然后在U形管中加入适量0.1mol?L-1的BaCl2溶液,充分振荡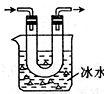 | 结合上述步骤1的有关结论 ①若 ②若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
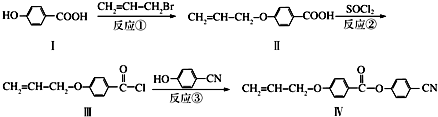
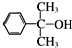 也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应且生成有机物Ⅴ.Ⅴ的结构简式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y元素最高价氧化物对应水化物的化学式为HYO4 |
| B、原子半径由小到大的顺序为:W>X>Z |
| C、Z元素可以形成两种酸性氧化物 |
| D、Y、Z两元素的气态氢化物中,Z的气态氢化物最稳定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com