
【题目】(1)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为________________。
(2)在标准状况下,50g CO和CO2的混合气体的体积为33.6L,则两种气体的物质的量之比为___________。
(3)浓度为36.5%的浓盐酸,其密度为1.19g/cm3,则该盐酸的物质的量浓度为___________。
(4)若20g密度为pg.mL-1的Ca(NO3)2溶液中含有2g Ca(NO3)2,则溶液中NO3-的物质的量浓度为_________。
(5)已知在碱性溶液中可发生如下反应:2R(OH)3+3C1O-+40H-=2RO4n-+3C1-+5H2O,则RO4n-中R的化合价是___________。
【答案】64g/mol 2:1 11.9mol/L ![]() mol/L +6
mol/L +6
【解析】
(1)12.4g Na2R含Na+ 0.4mol,则Na2R的摩尔质量为 = 64g·mol-1。
= 64g·mol-1。
(2)标准状况下,Vm=22.4L·mol-1,n=V÷Vm=33.6L÷22.4L·mol-1=1.5mol,
设CO的物质的量为x,CO2的物质的量为y,
则有:x+y=1.5 28x+44y=50
解之得:x=1mol,y=0.5mol,两种气体的物质的量之比=1:0.5=2:1;
(3)此浓盐酸的物质的量浓度为:c(HCl)=![]() mol·L-1=11.9mol·L-1
mol·L-1=11.9mol·L-1
(4)该硝酸钙溶液中溶质的质量分数为:2g÷20g×100%=10%,
则该溶液中硝酸钙的物质的量浓度为:c=![]() mol·L-1,
mol·L-1,
所以溶液中NO3-的物质的量浓度为:c(NO3-)=2c[Ca(NO3)2]=![]() mol·L-1×2=
mol·L-1×2=![]() mol·L-1;
mol·L-1;
(5)根据电荷守恒得3×1+4×1=3×1+2n,则n=2,所以RO4n-为RO42-,该离子中O元素化合价为-2价,R、O元素化合价的代数和为-2,所以该离子中R元素化合价=-2-(-2)×4=+6。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是
A. H2还原CuO的反应只属于还原反应
B. 置换反应都是氧化还原反应,所以,3CO+Fe2O3![]() 2Fe+3CO2既是置换反应又是氧化还原反应
2Fe+3CO2既是置换反应又是氧化还原反应
C. 3O2![]() 2O3是氧化还原反应
2O3是氧化还原反应
D. 复分解反应一定不是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为海水综合利用部分流程,有关说法不正确的是
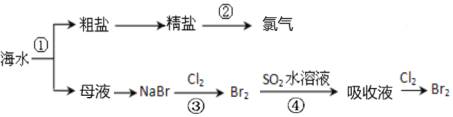
A.上述工艺流程中涉及到化合、分解、复分解和置换反应
B.①只发生物理变化
C.②是工业上电解饱和食盐水制备Cl2
D.③④涉及的反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A. 浓度为0.03 mol·L-1 B. 从中取出10 mL溶液,其浓度为0.03 mol·L-1
C. 含NaOH 0.6 g D. 从中取出10 mL溶液,含NaOH 0.015 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示的仪器和药品(必要时可加热),能够达到实验目的是( )
试剂a | 试剂b | 试剂c | 实验目的 |
| |
① | 盐溶液X | NaOH | 酚酞 | 证明X中含有NH4+ | |
② | 浓盐酸 | CaCO3 | Na2SiO3溶液 | 证明酸性: HCl>H2CO3>H2SiO3 | |
③ | 浓盐酸 | MnO2 | 淀粉KI溶液 | 证明氧化性:MnO2>Cl2>I2 | |
④ | 浓硫酸 | C | 澄清石灰水 | 证明产物中含有CO2 |
A.①②③B.①③C.②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]是一复盐,在造纸等方面应用广泛。某兴趣小组采用10.0g废易拉罐(含90%的Al,还含有少量的Fe、Mg等杂质)制备明矾的实验方案如下:
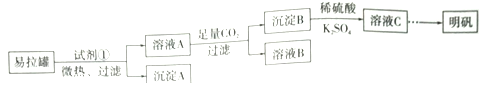
(1)试剂①应选用_____________(填代号)。
a.盐酸 b.H2SO4溶液 c.氯化钠溶液 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为____________________。
(3)溶液B中溶质的主要成分为____________________ (填化学式)。
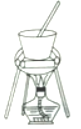
(4)从溶液C中得到明矾的实验操作步骤为蒸发浓缩、__________(填操作名称)、过滤、洗涤、干燥。如下图所示,蒸发操作中的一处错误是_____________。
(5)该小组在实验完成之后,得到118.5 g明矾,则明矾的回收率为_____________。(已知:明矾的摩尔质量为474g·mol-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 下列说法正确的是( )
A.室温下,反应NH3(g)+HCl(g)=NH4Cl(s)能自发发生反应,则该反应的△H<0
B.甲醇燃料电池工作时,甲醇得到电子,发生还原反应
C.常温下,0.1molL﹣1CH3COOH溶液加水稀释后,溶液中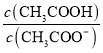 的值减小
的值减小
D.在Na2CO3溶液中加入少量Ca(OH)2固体,CO32﹣水解程度减小,溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com