
【题目】苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
NA代表阿伏加德罗常数的值。下列有关说法正确的是
A.气态苯乙酮的密度是气态乙酸密度的2倍
B.1mol苯所含的化学单键数目为12 NA
C.0.5mol乙酸酐中含有的电子数目为27 NA
D.1L2mol/LCH3COOH溶液与足量钠反应生成的气体分子数为NA
【答案】C
【解析】
A.气态苯乙酮的摩尔质量为120g/mol,气态乙酸的摩尔质量为60g/mol,根据ρ=![]() ,二者气态物质的状态条件未知,体积无法确定,则密度无法确定,故A错误;
,二者气态物质的状态条件未知,体积无法确定,则密度无法确定,故A错误;
B.苯的结构中,只有碳氢单键,碳碳之间是一种介于单键与双键之间的一种特殊键,则1个苯分子中有6个单键,1mol苯中含有6mol单键即6 NA个,故B错误;
C.一个乙酸酐分子中含有54个电子,1mol乙酸酐分子中含有54mol电子,则0.5mol乙酸酐中含有27mol电子,即电子数目为27 NA,故C正确;
D.1L2mol/LCH3COOH的物质的量为2mol,与钠反应生成氢气1mol,足量钠,醋酸消耗完可继续与水反应,则生成的气体分子数大于NA个,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以旋转,结构简式为 ![]() 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中最多有6个碳原子处于同一直线上
B. 该烃苯环上的一氯代物有3种
C. 分子中至少有12个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浓度的氨水中存在下列平衡:NH3H2O![]() NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是( )
NH4++OH-,若想增大NH4+的浓度,而不增加OH-的浓度,应采取的措施是( )
①适当升高温度 ②加入NH4Cl 固体 ③通入NH3 ④加入少量盐酸
A. ①②B. ②③C. ③④D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mL 0.1molL-1NaOH溶液中加入0.1molL-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
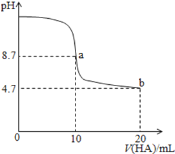
A. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B. b点所示溶液中c(A-)>c(HA)
C. pH=7时,c(Na+)=c(A-)+c(HA)
D. a、b两点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种用来合成医药、农药的重要原料,某化学课外活动小组用如图装置制取溴苯。先向分液漏斗中加入苯和液溴,在A下端活塞关闭的前提下,再将混合液慢慢滴入反应器A中。
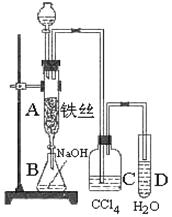
(1)写出A中反应的化学方程式_________________________________________________
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_____________________,C中盛放CCl4的作用是_______________________________________;
(3)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入______溶液,现象是_____________________________,则能证明;或者向试管D中加入______溶液,现象是_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是________(填“I”或“Ⅱ”);
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H1________0 (填“>”、“=”或“<”);
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________(从上表中选择);
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=﹣566.0kJ/mol
③H2O(g)=H2O(l) △H=﹣44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___________;
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
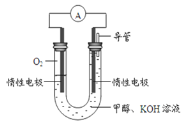
①该电池正极的电极反应为___________;
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
(1)催化反应室中的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),计算ΔH=_______。反应来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
,每生成1mol H2需要吸收131.3kJ的热量。写出该反应的热化学方程式____________。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
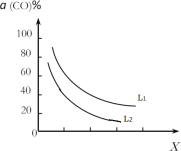
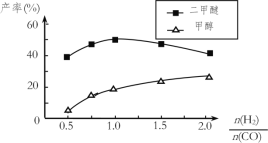
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
实验 | 试剂甲 | 试剂乙 | 试剂丙 | 实验结论 |
|
A | 浓硝酸 | 铜片 | 淀粉—KI溶液 | 氧化性:NO2>I2 | |
B | 稀硫酸 | FeS | 含AgNO3的AgCl浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
C | 浓氨水 | CaO | 紫色石蕊溶液 | 氨水呈碱性 | |
D | 稀盐酸 | 石灰石 | BaCl2溶液 | 丙中生成BaCO3沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个容积固定的5 L反应器中,有一可左右滑动的密封隔板,左侧进行如下可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
![]()
A.若左侧开始反应时v正>v逆,则5>x>1.75
B.若左侧开始反应时x=1.75,则起始时v正=v逆
C.若左侧开始反应时x=2,则达到平衡时混合气体中SO2所占的体积分数为25%
D.若左侧开始反应时x=1.65,则达到平衡时SO3的转化率为10%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com