
【题目】一个容积固定的5 L反应器中,有一可左右滑动的密封隔板,左侧进行如下可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
2SO3(g),通过控制温度使其达到不同的平衡状态;右侧充入氮气,两侧温度保持相等。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25 mol、1 mol;右侧中加入9 mol的氮气。左侧反应达到平衡时,隔板恰好处于反应器位置2处。则下列说法错误的是
![]()
A.若左侧开始反应时v正>v逆,则5>x>1.75
B.若左侧开始反应时x=1.75,则起始时v正=v逆
C.若左侧开始反应时x=2,则达到平衡时混合气体中SO2所占的体积分数为25%
D.若左侧开始反应时x=1.65,则达到平衡时SO3的转化率为10%
【答案】D
【解析】
由左侧反应达到平衡时,隔板恰好处于反应器位置2处可知,左右容器体积之比为2:3,由阿伏加德罗定律可得平衡时左容器中气体的物质的量为![]() =6mol。
=6mol。
A.该反应为气体体积减小的反应,由左侧开始反应时v正>v逆可知,起始时气体的物质的量大于6mol,即(x+3.25+1)>6,解得x>1.75;若3.25 mol氧气完全反应,可得反应后混合气体的物质的量为(x-6.5+1-6.5)mol,由(x-6.5+1-6.5)=6解得,x=5,因可逆反应不可能完全反应,则x<5,故有5>x>1.75,故A正确;
B.若左侧开始反应时x=1.75,混合气体的物质的量为(1.75+3.25+1)=6,说明反应达到平衡,则起始时v正=v逆,故B正确;
C.若左侧开始反应时x=2,(2+3.25+1)mol=6.25mol>6mol,说明平衡向正反应方向进行,设反应消耗amol二氧化硫,由题意建立如下三段式:

由平衡时气体的物质的量为6,可得(2-2a)+(3.25-a)+(1+2a)=6,解得a=0.25,平衡时二氧化硫的物质的量为1.5mol,平衡时混合气中SO2所占的体积分数为![]() ×100%=25%,故C正确;
×100%=25%,故C正确;
D.若左侧开始反应时x=1.55,(1.55+3.25+1)mol=5.8mol<6mol,说明平衡向逆反应方向进行,设反应消耗amol二氧化硫,由题意建立如下三段式:

由平衡时气体的物质的量为6,可得(1-2a)+(3.25+a)+(1.55+2a)=6,解得a=0.2,即转化率为20%,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】苯乙酮常温下为无色晶体或浅黄色油状液体,是山楂、含羞草、紫丁香等香精的调合原料,并广泛用于皂用香精和烟草香精中,可由苯经下述反应制备:
![]() +(CH3CO)2O
+(CH3CO)2O![]()
![]() +CH3COOH
+CH3COOH
NA代表阿伏加德罗常数的值。下列有关说法正确的是
A.气态苯乙酮的密度是气态乙酸密度的2倍
B.1mol苯所含的化学单键数目为12 NA
C.0.5mol乙酸酐中含有的电子数目为27 NA
D.1L2mol/LCH3COOH溶液与足量钠反应生成的气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 molL-1NH3H2O标准溶液滴定20 mL0.10 molL-1盐酸与未知浓度CH3COOH的混合溶液,混合溶液的相对导电能力变化曲线如图所示,已知Kb(NH3·H2O) =Ka(CH3COOH)。下列叙述错误的是
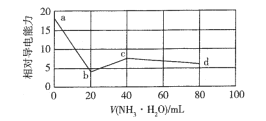
A.H+的导电能力大于等浓度的NH4+
B.a点混合溶液中c( CH3COO- ) +c( CH3COOH) =0.10 molL-1
C.b点混合溶液中,c( NH4+ ) +c( NH3H2O) >c( CH3COOH)
D.c点混合溶液中,c(NH4+) >c(Cl-) >c(CH3COO-) >c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置中同时通入a、b两种气体,瓶中实验现象错误的是
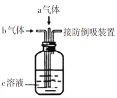
选项 | a气体 | b气体 | c溶液 | 实验现象 |
A | Cl2(1mol) | SO2(1mol) | 品红溶液 | 溶液颜色变浅或褪色 |
B | H2S | SO2 | 水 | 产生淡黄色沉淀 |
C | SO2 | NO2 | BaCl2溶液 | 产生白色沉淀 |
D | NO | O2 | 滴加少量酚酞的NaOH溶液 | 溶液颜色变浅或褪色 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图像的结论正确的是
图像 | 结论 | |
A |
| 相同质量锌粉分别与1 mol/L盐酸及相同体积未知浓度的盐酸反应,未知浓度盐酸的浓度低于1 mol/L |
B |
| 一定条件下,金刚石转化为石墨要释放能量,金刚石要比石墨稳定 |
C |
| 该装置为化学能转化为电能的装置,且Mg作负极 |
D |
| 一定条件下,某可逆反应的正反应速率和逆反应速率随时间变化曲线如图,反应开始时刻生成物的浓度不为0 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛的化合物如TiO2、Ti(NO3)4、TiCl4、Ti(BH4)2等均有着广泛用途。
(1)写出Ti的基态原子的外围电子排布式_____。
(2)TiCl4熔点是﹣25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于_____晶体;BH4﹣中B原子的杂化类型为_____。
(3)在 TiO2催化作用下,可将CN﹣氧化成CNO﹣,进而得到N2。与CNO﹣互为等电子体的分子化学式为(只写一种)________。
(4)Ti3+可以形成两种不同的配合物:[Ti(H2O)6]Cl3(紫色),[TiCl(H2O)5]Cl2H2O(绿色)。绿色晶体中配体是_______。

(5)TiO2难溶于水和稀酸,但能溶于浓硫酸,析出含有钛酰离子的晶体,钛酰离子常成为链状聚合形式的阳离子,其结构形式如图1,化学式为______。
(6)金属钛内部原子的堆积方式是面心立方堆积方式,如图2。若该晶胞的密度为ρgcm﹣3,阿伏加德罗常数为NA,则该晶胞的边长为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,碘酸钾(KIO3)和Na2SO3可发生如下反应:2![]() +5
+5![]() +2H+=I2+5
+2H+=I2+5![]() +H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
+H2O,生成的碘可以用淀粉溶液检验,根据溶液出现蓝色所需的时间来衡量该反应的速率。某学生设计实验如下表所示(表格中体积单位均为mL):
0.01mol/LKIO3溶液的体积 | 某浓度的Na2SO3溶液的体积 | H2O的体积 | 实验温度/℃ | 溶液出现蓝色所需时间 | |
实验1 | 5 | 5 | V1 | 0 | a |
实验2 | 5 | 5 | 20 | 25 | b |
实验3 | 5 | V2 | 15 | 25 | c |
(1)V1=______ mL,V2=______ mL。
(2)如果研究浓度对反应速率的影响,使用实验__________和实验__________。
(3)对比实验1和实验2,可以研究__________对化学反应速率的影响。
(4)溶液出现蓝色所需的时间从多到少的顺序是__________(用a、b、c表示)。
(5)已知反应:2Na2SO3(aq)+O2(aq)=2Na2SO4(aq)。在291.5K时,1.0 L溶液中Na2SO3初始量为10 mmol(1 mol=103 mmol),每5s记录一次溶解氧浓度,一段时间后实验结果如曲线,求0-40s内Na2SO
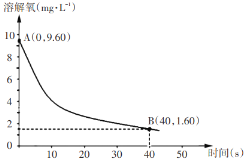
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用洗净的废铜屑作原料来制备硝酸铜。为了节约原料和防止污染环境,宜采取的方法是
A. Cu![]() CuSO4
CuSO4![]() Cu(NO3)2
Cu(NO3)2
B. Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
C. Cu![]() Cu(NO3)2
Cu(NO3)2
D. Cu![]() Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的信息,下列叙述正确的是( )
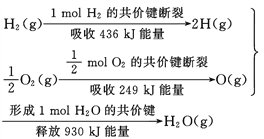
A. 2 mol H2(g)跟 1 mol O2(g)反应生成 2 mol H2O(g)吸收能量为490 kJ
B. 化学反应中能量变化的大小与反应物的质量多少无关
C. 1 mol H2(g) 跟0.5mol O2(g) 反应生成 1 mol H2O(l)释放能量为245 kJ
D. 2molH2O (g)的能量比2 mol H2(g)与1 mol O2(g)的能量之和低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com