
����Ŀ����ҵ�����������Ҫ��Ӧ֮һΪ2SO2(g)+O2(g)![]() 2SO3(g)����Ӧ�����������ı仯��ͼ��ʾ��
2SO3(g)����Ӧ�����������ı仯��ͼ��ʾ��

��1����ͼ��֪�÷�Ӧ������ӦΪ_____________(��������������������)��Ӧ��
��2�������¶ȣ�ƽ����_________(��������Ӧ�������淴Ӧ��)�����ƶ�������Ӧ����_____(��������������С����������������ͬ�����淴Ӧ����_____________��
��3����Ӧ��ϵ�м��������ͼ��E1____(��������������С����������������ͬ����E3___________��
��4����֪��2H2S(g)+O2(g)=2S(s)+2H2O(g) ��H=-442.4 kJ��mol-1��
S(s)+O2(g)=SO2(g) ��H=-297.0 kJ mol-1��
��H2S(g)��O2(g)��Ӧ����SO2(g)��H2O(g)���Ȼ�ѧ����ʽ��_________________�����˷�Ӧת��3 mol����ʱ���ų�������Ϊ_______kJ��
���𰸡� ���� �淴Ӧ ���� ���� ��С ���� 2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ��H=-1036.4kJ��mol-1 259.1
��������(1)��Ӧ�з�Ӧ�����������������������������ʷ�ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ� (2) ���£����ȷ�Ӧ�����ƶ�������Ӧ���淴Ӧ���ʶ����ʴ�Ϊ���淴Ӧ��������������3��������������Խ��ͷ�Ӧ�Ļ��E1������Ӧ��E3���䣬�ʴ�Ϊ����С�����䣻��4�����ݸ�˹���ɷ�������2H2S(g)+O2(g)=2S(s)+2H2O(g) ��H=-442.4 kJ��mol-1��
��S(s)+O2(g)=SO2(g) ��H=-297.0 kJ mol-1������+�ڡ�2���ɵ��Ȼ�ѧ����ʽΪ2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ��H=-442.4-297.0��2=-1036.4kJ��mol-1���÷�Ӧ��ת��12Ħ�����ӣ����Ե�ת��3Ħ������ʱ�ų�������Ϊ1036.4/4= 259.1 kJ���ʴ�Ϊ��2H2S(g)+3O2(g)=2SO2(g)+2H2O(g) ��H=-1036.4kJ��mol-1 �� 259.1��


 Сѧ��ʱ��ѵϵ�д�
Сѧ��ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ö��Ե缫�������ͭ��Һ����������ת�Ƶ��ӵ����ʵ������������������Ĺ�ϵ��ͼ��ʾ(�������������ͬ״���²ⶨ)����ʹ��Һ�ָ�����ʼ״̬��������Һ�м���
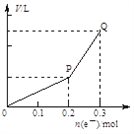
A. 0.1 mol CuO B. 0.05 mol Cu2(OH)2CO3
C. 0.1 mol Cu(OH)2 D. 0.1 mol CuCO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2YΪ��Ԫ���ᣬ��ʽ��NaHY��ˮ��Һc(OH-)��c(H+),����������ȷ����
A. H2Y�ĵ��뷽��ʽ��H2Y![]() 2H+ +Y2-
2H+ +Y2-
B. HY-��ˮ�ⷽ��ʽ��HY- + H2O![]() H3O+ + Y2-
H3O+ + Y2-
C. ����ʽ����Һ������Ũ�ȹ�ϵ��c(Na+)��c(HY-)��c(OH-)��c(H+)
D. ����ʽ����Һ������Ũ�ȹ�ϵ��c(Na+)��c(Y2-)��c(HY-)��c(OH-)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������У�����������()
A.�þƾ��Ƽ����ձ�����ƿʱ�����ʯ����
B.����ʱ��������������������������ǿ���
C.������ƿ��ֱ���ܽ�ҩƷ
D.ϡ��Ũ����ʱ����Ũ���Ỻ��ע��ˮ�в����Ͻ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.10mol/L HA(Ka=10-9.89)��Һ,������ҺpH����[HA] + [A-]=0.10mol/L�����й�ϵ��ȷ����
A. pH=2.00ʱ��[HA] > [H+]> [OH-] > [A-]
B. pH=7.00ʱ��[HA] = [A-] > [OH-]= [H+]
C. pH=9.89ʱ��[HA] = [A-] > [OH-]> [H+]
D. pH=14.00ʱ��[OH-]>[A-]>[H+]>[HA]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Ҳ���HCl�������û�����ˮ���������ϵķ��������۵��Ȼ�п�Ʊ��ߴ�����ˮ�Ȼ�п,װ����ͼ��ʾ[�����Ȼ�п��Zn(OH)Cl]������˵������ȷ����

A. ��ѹ©����������ƽ������ѹǿ
B. ��ʽ¯����ȡ�����·�ʽ�ǽ�ʽ����
C. ʵ��ʱ,Ӧ����ȥ��ʽ¯�����ٳ�ȥ��ʽ¯��
D. ��β������װ��ǰӦ����һ������װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ�����й��ڸ�ʵ��������У�����ȷ��
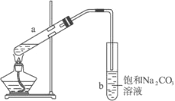
A. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���Ŀ���Ƿ�ֹʵ������в�����������
B. ʵ��ʱ�����Թ�a��Ŀ��֮һ�Ǽӿ췴Ӧ����
C. �Թ�b�б���Na2CO3��Һ��������������������������������������Ҵ��������������������ܽ�
D. a�Թ����ȼ���Ũ���ᣬȻ���ҡ���Թܱ����������Ҵ����ټӱ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ˮ�д��ڵ�ƽ�⣺H2O ![]() H�� + OH��������������ȷ����
H�� + OH��������������ȷ����
A. ��ˮ���ȣ�Kw����pH����
B. ����ϡ���ᣬƽ�������ƶ���c(H+)����
C. ��������������Һ��ƽ�������ƶ���Kw��С
D. ������������CH3COONa��ƽ�������ƶ���c(H��)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���£�N2H4���ֳ��������㷺���ڻ���ƽ������л��ϳɼ�ȼ�ϵ�أ�NO2�Ķ�����N2O4���ǻ���г�������������ȼ�ϵ��ԭ����ͼ��ʾ��ͨ�������ĵ缫�Ϸ����ĵ缫��ӦʽΪ____________________��

��2����2 L�ܱ������У�800 ��ʱ��Ӧ2NO(g)��O2(g) ![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
�ٵ���ƽ��ʱNO��ת����Ϊ_________��
����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��____________________��
������ͼ��ʾ����ʾNO2�仯���ߵ���________��

����˵���÷�Ӧ�Ѵﵽƽ��״̬����________(�����)��
A��v(NO2)��2v(O2) B��������ѹǿ���ֲ���
C��v��(NO)��2v��(O2) D�������ڵ��ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com