
【题目】对危险化学品要在包装上印上警示性标志,下列化学品的名称与警示性标志名称对应正确的是
A. 烧碱——爆炸品B. 浓硫酸——剧毒品
C. 汽油——腐蚀品D. 酒精——易燃品
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组同学为探究黑木耳中含铁量,进行如下实验。
已知:i.黑木耳富含蛋白质、糖类、卵磷脂、铁及一些还原性物质(如维生素![]() )等。每100克黑木耳含铁高达185毫克。
)等。每100克黑木耳含铁高达185毫克。
ii.紫色的![]() 溶液在酸性条件下具有强氧化性,其还原产物是无色的
溶液在酸性条件下具有强氧化性,其还原产物是无色的![]() 。
。
I:为确定黑木耳中含有铁元素,甲同学设计实验方案如下。
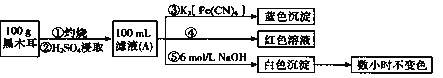
(1)步骤②得到滤液A的操作是_________。
(2)步骤④检验![]() 所用试剂是_________溶液。
所用试剂是_________溶液。
(3)下列有关上述实验得出的结论是_____(填字母符号)。
a.黑木耳中一定含![]() 和
和![]()
b.滤液A中一定含![]() 和
和![]()
c.白色沉淀中一定含![]()
II:为测定黑木耳中铁元素的含量,乙同学设计实验方案如下。
![]()
(4)可选作试剂B的物质是__________(填字母序号)
a. ![]() b.
b. ![]() c.
c. ![]() d.
d. ![]()
(5)步骤⑦中观察到的实验现象是_________,反应的离子方程式是____________。
(6)若同学实验操作规范,但测得含铁量远大于实际的含量,其可能的原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校甲、乙两个化学小组学生利用下图所示装置进行“铁与水反应及相关性质”的实验。
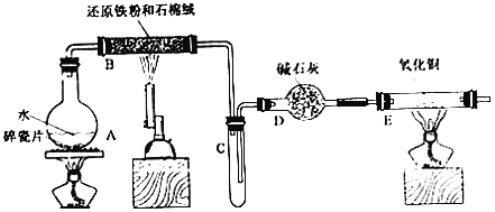
(1)装置B中发生反应的化学方程式是____________________________________。
(2)装置E中的现象是___________________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________________________。
②甲组步骤1中反应的离子方程式为______________________________________。
③乙组步骤4中,溶液变红的原因为____________________、___________________;(用离子方程式表示);溶液褪色可能的原因是_____________________________;验证方法为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示装置进行铁跟水蒸气反应的实验,并继续研究铁及其化合物的部分性质。

(1)试管中发生反应的化学方程式为_______________________________。
(2)该同学欲确定反应一段时间后试管中固体物质的成分,设计了如下方案:
①待试管冷却,取其中固体少许溶于稀盐酸得溶液B;
②取少量溶液B滴加KSCN溶液,若溶液变红,则试管中固体是________(只有一个选项符合题意),若溶液未变红,则试管中固体是________(只有一个选项符合题意)。
A.一定有Fe3O4,可能有Fe
B.只有Fe(OH)3
C.一定有Fe3O4和Fe
D.一定有Fe(OH)3,可能有Fe
E.只有Fe3O4
(3)该同学按上述方案进行了实验,溶液未变红色,原因是: __________________________(用离子方程式表示)。
(4)该同学马上另取少量溶液B,使其跟NaOH溶液反应。若按右图所示的操作,可观察到生成白色沉淀,迅速变成灰绿色,最后变成红褐色的现象,请写出与上述现象相关反应的化学方程式__________________________________________________,______________________________________。

(5)一段时间后,该同学发现(3)中未变红的溶液变成红色。由此可知,实验室FeCl2溶液需现用现配的原因是___________________________________,并且配制时应加入少量________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 加水稀释0.01 mol·L-1的CH3COOH溶液,溶液中c(OH-)减小
B. 室温时,0.1 mol·L-1的某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C. 氨水加水稀释后,溶液中![]() 的值增大
的值增大
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2 )是二元弱碱,在水中的电离原理类似于氨。常温下,向乙二胺溶液中滴加稀盐酸,溶液的pH随离子浓度变化关系如图所示。下列叙述不正确的是
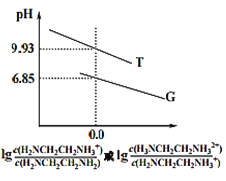
A. Kb2[H2NCH2CH2NH2] 的数量级为10-8
B. 曲线G代表pH 与![]() 的变化关系
的变化关系
C. H3NCH2CH2NH2Cl溶液中c(H+)>c(OH-)
D. 0.01mol·L-1H2NCH2CH2NH2 电离度约为10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通锌锰电池(俗称干电池)构造如图所示。

(1)普通锌锰电池放电时发生的主要反应为:Zn+2NH4Cl+2MnO2===Zn(NH3)2Cl2+2MnOOH
①正极发生的主要反应是____________;
②普通锌锰电池即使不使用,也易发生电解质的泄漏,结合电池结构及相关知识,用适当的化学用语及文字解释原因___________;
(2)下左图表示回收利用废旧普通锌锰电池的工艺(不考虑废旧电池中存在的少量其他金属)。

①滤液加入稀盐酸反应的化学方程式为____________,冷却得到化合物B的化学方程式为____________;
②操作a中得到熔块的主要成分是K2MnO4,在操作a中,KClO3的作用是______;
③操作b中,绿色的K2MnO4溶液反应后生成紫色溶液和一种黑褐色固体,该反应的离子方程式为____________;黑褐色固体可循环使用,检验其是否洗涤干净的实验方案是___________;
④采用惰性电极电解K2MnO4溶液也能得到化合物D,写出其对应的电极反应_______。
⑤往化合物A的溶液中加入足量的氢氧化钠溶液。溶液中离子浓度随pH变化如图所示,回答下列问题:

i M(OH)2属于____________氢氧化物(填“酸性”、“碱性”、“两性”或“中性”);
ii从图中数据可得M(OH)2的Ksp=____________;
iii往2L 1.00mol·L-1 A溶液中加入NaOH固体至pH=6.00,需NaOH=___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为Ts(中文名“ ![]() ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
A. Ts是第七周期第ⅦA族元素 B. Ts的同位素原子具有相同的电子数
C. Ts在同族元素中非金属性最弱 D. 中子数为176的TS核素符号是 ![]() Ts
Ts
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。基态Ni原子的外围电子排布式为 ,该元素位于元素周期表中的第 族。
(2)碳元素能够形成不同的单质,如C60、C70、金刚石等等。
①C60、C70、金刚石这些单质间互称为 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。

③继C60后,科学家又合成了Si60、N60, C、Si、N三种原子电负性由大到小的顺序是 。
(3)铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
①Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为 。
②Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com